
ヒトの肝臓から採取した初代肝細胞は、ドナーによる個体差や供給量の限界といった問題が生じるが、これらの問題を解決したヒト化肝臓キメラマウス由来肝細胞「HepaSH細胞」を開発したのが実験動物中央研究所・研究部門長の末水洋志氏だ。
実験動物中央研究所(川崎市)は1952年に創立された民間の研究所で、公益に資することを目的に実験動物の品質管理に関する基礎研究を続けてきた。1979年には世界で唯一国際実験動物学会議(ICLAS)から実験動物の遺伝および微生物学的な品質管理センターとして認定されている。
1980年代にはトランスジェニックマウスの技術を日本にいち早く導入するとともにその実用化開発にも注力し、ヒト化マウスや免疫不全マウス、ポリオウイルス感染モデルマウスなど多様な実験用遺伝子改変マウスを生み出している。
その一つが、短期発がんモデルのrasH2マウスである。従来、医薬品など化学物質の発がん性を評価するには2年間を要する動物試験が必要であったが、rasH2マウスは短期間で発がん物質に反応するため、4分の1の26週間でその評価が可能である。同研究所はrasH2マウスの安定計画生産技術を確立し、日米欧の産官学50以上の施設と連携して検証試験を実施し、rasH2マウスによる発がん性試験の評価結果が従来法より精度が高いことを確認。2022年のICHガイドライン(S1B)改正で「がん原性試験ではrasH2マウスを用いる」と記載され、rasH2マウスが世界的基準動物となった。
末水氏は2000年に同研究所に入所し、遺伝子改変動物などの基礎研究に携わってきた。入所後にまず取り組んだのが、当時の先端技術であったクローンマウス技術であり、この研究から均一なマウスの重要性や実験環境統御の必要性が刷り込まれた。
その後取り組んだのが、遺伝子改変動物の遺伝的安定性の研究だ。「当時の遺伝子改変技術では染色体の中に組み込んだ遺伝子が不安定で、交配して代を重ねると性質が変わってしまうことがあった。rasH2マウスにもそのような疑問が呈されていた」
末水氏は数千個体のrasH2マウスの遺伝子を調べ、5世代程度の継代では遺伝子は変化せず、どの個体でも均質ながん原性試験結果が出ることを立証し、同マウスを世界標準にする基礎データの構築に貢献した。
また、もうひとつの重要な研究テーマが、同研究所が樹立したヒト化免疫不全マウス「NOGマウス」の応用研究である。NOGマウスは極めて重度な複合型免疫不全を呈するため、がん細胞をはじめとするさまざまなヒトの細胞が生着しやすいという特性を持つ。
末水氏はNOGマウスとマイクロアレイ技術を用いて、がん転移に関わる分子の遺伝子解析を行い、この方法でさまざまな転移分子が見つかることを報告している。
マウスの肝細胞を破壊してからヒト肝細胞を移植
このNOGマウスの応用研究から生み出されたのが、ヒト化肝臓キメラマウスであり、さらにそこから「HepaSH細胞」が誕生する。
末水氏は「NOGマウスにはがん細胞だけでなく、正常な細胞を含めて多様な異種細胞が生着することが明らかになってきた。ヒトとマウスの肝代謝は種差が大きいが、NOGマウスにヒト肝細胞を注入してヒトの肝臓を持つマウスを作製すれば、簡単に毒性試験や肝代謝の試験が行えるようになる」と考えて実験を重ねた。だが、単にNOGマウスに市販されているヒト初代肝細胞を移植しただけでは、生着はほとんど見られなかった。
そこで末水氏は、同研究所のヒト化免疫モデルマウスの作製で用いられ、成功を収めていたマウスの骨髄細胞を壊してからヒト細胞を移植するという手法を応用することにした。この手法で作製されたのがヒト化肝臓キメラマウス(TK-NOGマウス)で、NOGマウスにウイルス由来のHSV-TK遺伝子を導入した後、ガンシクロビルを投与して肝障害を発生させ、そこに市販のヒト初代肝細胞を移植したものである。ヒト肝細胞はマウスの肝細胞が死んでできた空間で増殖する。「このマウスの肝臓を病理組織学的に解析すると、最終的にヒト肝細胞が肝臓の95%以上を占めるようになった」と末水氏は話す。
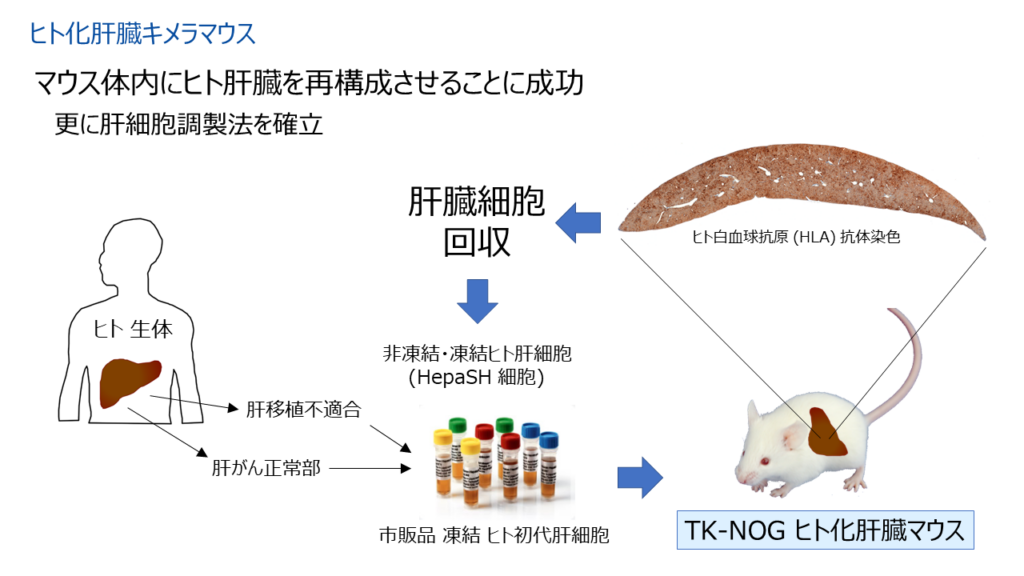
既にヒト化肝臓キメラマウスは薬物動態や肝疾患の動物実験に用いられるようになっているが、このマウスから肝細胞だけを単離したものがHepaSH細胞で、in vitroの研究に利用することができる。
末水氏は「HepaSH細胞は、これまでのヒト初代肝細胞の概念を覆すような2つの特徴を持つ」と強調する。
その一つは、ヒトから直接、採取した肝細胞(初代肝細胞)は増やすことができないと考えられていたが、マウスの体内に適切な環境を提供することにより数十倍に増やせることである。ドナー1人から得られる肝細胞の量は少なく、同じドナーのヒト初代肝細胞はせいぜい数百~千バイアル程度しか世に出ない。
だが、HepaSH細胞作製技術を用いることにより1バイアルのヒト初代肝細胞から、数十バイアルの細胞が調製できるため、供給の安定性と継続性に格段の差が出てくる。
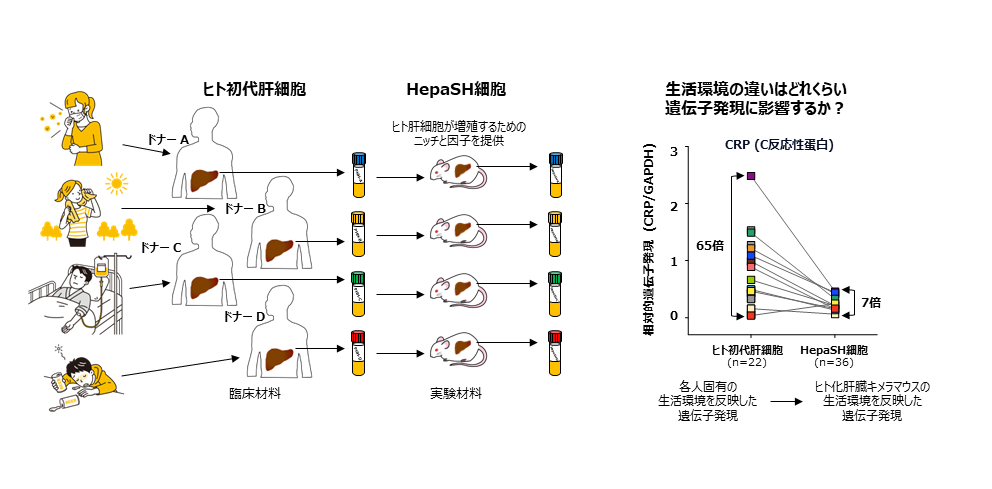
もう一つは、従来のヒト初代肝細胞はドナーの違いによる個体差が大きいことが知られているが、HepaSH細胞では個体間差が小さく、均質な細胞になることである。
「ヒト初代肝細胞はドナーが違えば薬物代謝酵素活性などが大きく異なる。個体差はドナーの肝摘出時の健康状態を反映したもので、遺伝的要因と外部・生活環境要因で生じるが、実は外部・生活環境が与える影響が大きい」と末水氏は指摘する。
HepaSH細胞では個々のドナーの遺伝的要因は受け継がれるが、マウスで培養する条件は同一であるため、外部・生活環境による影響は完全に排除される。末水氏は「ドナーが健康であったときに近いと思われる状態で細胞を再現したのがHepaSH細胞だといえる」と説明し、「例えば、ヒト初代肝細胞のCRPを測定すると個体差は最大65倍もあったが、同じドナー群の細胞をHepaSH細胞に加工すると個体差は最大7倍に縮小した。多くの薬物代謝酵素で同様の結果が出ている」と続ける。
他にも、HepaSH細胞には、「凍結せずに冷蔵輸送可能なため、実験に要する手間が少ない」、「全ての細胞が接着能を有するために単層培養も3次元培養も容易」といった特徴もある。
末水氏は「研究者の多くは、ヒト初代肝細胞は普通のヒトの特性を反映していると認識されているが、実はドナーの健康状態を反映した個体差が大きい。創薬でいえば、異なるドナーのヒト肝細胞を用いるのは、違うモノサシで化合物を評価しているようなものだ。個体差の小さなHepaSH細胞を用いることで毎回、同じ条件で化合物を評価できるようになる。新たな世界基準となり得るヒト肝細胞だといえるだろう」と話している。


