サルコペニアに対する治療法開発の基盤として期待

脇裕典秋田大学大学院医学系研究科代謝・内分泌内科学講座教授のグループは、関西電力医学研究所、藤田医科大学、岐阜大学との共同研究で、食後に分泌が増加する消化管ホルモンGIP (Gastric inhibitory polypeptide) が骨格筋の間葉系前駆細胞の脂肪分化を促進し、サルコペニア(老化による筋量・筋機能の低下)の一因となることを明らかにした。さらに、このホルモンの作用シグナルの抑制により、サルコペニアが改善することも見出した。
同研究は、筋肉老化の新しいメカニズムを提示するのみならず、サルコペニアの新規治療法開発の基盤となることが期待される。これらの研究成果は、国際医学誌『Journal of Cachexia, Sarcopenia and Muscle』での掲載に先立ち、10月27日にオンライン公開された。
わが国は世界有数の長寿国だが、平均寿命と健康寿命の間には男女とも約10年の乖離があり、健康寿命の延伸が課題となっている。身体を動かす筋肉を総称して骨格筋と呼ばれている。骨格筋は、身体を動かすのみならず、血糖値をはじめとした代謝調節の作用を持つなど健康を保つうえで重要な役割を果たしており、骨格筋の若い状態の維持が健康寿命延伸には不可欠となている。
だが、骨格筋は加齢に伴ってその量と機能が低下することが知られている。この骨格筋の老化をサルコペニアといい、近年解決すべき健康課題の一つとなっている。サルコペニアは、種々の要因で引き起こされるがが、その一つに骨格筋内脂肪(Intramuscular adipose tissue, IMAT)蓄積がある。これは、いわば ”牛肉の霜降り”のごとく骨格筋内に脂肪が沈着している状態で、ヒトでも起こっており加齢とともにこのIMATが増加し、IMATが増加すれば筋力が低下する。
骨格筋内にある間葉系前駆細胞 Fibro/adipogenic progenitors(FAPs)が脂肪細胞に分化(=特定の機能を持つ細胞に変化すること)して、IMATを構成するが、これを調節するメカニズムについては十分明らかとなっていない。
そこで、脇氏らの研究グループは、長年、GIPと呼ばれる消化管ホルモンを研究してきた。GIPは脂肪細胞の成熟化を促し、肥満を促進する作用があるため、このGIPが間葉系前駆細胞の脂肪分化の調節を介して、IMATを増加させると考え、研究に取り組んだ。
研究では、まず、GIPの役割を明らかにするため、GIPの受け手であるGIP受容体を欠損している遺伝子改変マウス(GIP受容体欠損マウス)を高齢条件で検討を行った。
野生型マウス(=GIP受容体が働いている通常のマウス)では、高齢になると体脂肪率が増え、逆に筋肉量が減り、握力が弱くなる。だが、GIP受容体欠損マウスは高齢になっても、骨格筋を含む除脂肪組織の割合が多く、脚の筋肉群は重量が大きく、また握力が強いことを示した(図1)。

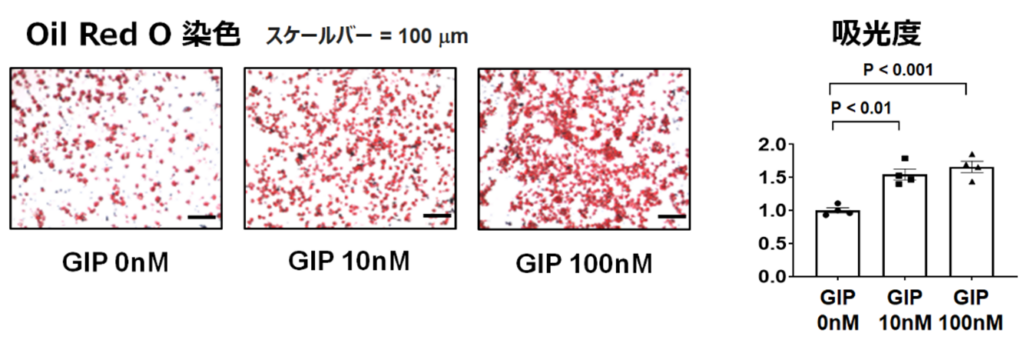
続いて、野生型マウスの骨格筋から間葉系前駆細胞を取り出して、この細胞の性質を調べました。間葉系前駆細胞にはGIP 受容体が発現しており、GIP を添加することで間葉系前駆細胞の脂肪分化の効率が上昇することがわかった(図2)。
実験的にIMAT 形成を誘導する方法として、グリセロール筋注法がある。これは、マウスの前脛骨筋と呼ばれる脚の筋肉にグリセロールを注射する実験方法である。GIP 受容体欠損マウスではグリセロール筋注後のIMAT 形成が抑制されていた。
また、筋線維の断面積が大きくなっていることを確認した。野生型マウスにGIP 受容体の働きをブロックする薬剤(GIP 受容体拮抗薬)を投与したところ、同様に、グリセロール筋注後のIMAT 形成が抑制され、また、筋線維の断面積が大きくなっていることを確認した(図3,4)。


間葉系前駆細胞は脂肪分化しIMAT形成に関わる一方で、未分化な間葉系前駆細胞は筋形成を促進する物質を放出して、筋肉量の維持に寄与することが近年注目されている。
従って、これらの結果から、GIP受容体シグナルの抑制により、単にIMATを減らすのみならず、骨格筋量の増加に寄与することが考えられる。また、GIP受容体拮抗薬によりIMATの形成を抑制できたという研究結果は、サルコペニアに対する治療法開発の基盤となると期待される。


