
経口薬を開発する上で、消化管からの薬物吸収性を評価することは極めて重要だ。しかし、これまで、創薬の過程において繁用されるin vitro実験系は大腸がん由来の細胞株を用いたものであり、実際に薬物吸収が行われる部位である小腸の正常細胞は用いられていなかった。北里大学の前田和哉教授(薬学部薬剤学教室)は、ヒト小腸の手術残余検体を活用した実験系を構築し、より精度の高い薬物吸収性予測を実現する研究を進めている。
前田教授の専門分野は薬物動態研究であり、長年、主にヒト薬物動態の支配要因としての肝臓のトランスポーターの役割について研究していたが、ある時期から消化管における薬物吸収の研究にシフトした。
「もともと力を入れていたのは、肝臓からの薬物消失や薬物相互作用の程度を定量的に予測する研究だったが、その当時、肝臓ではようやくヒトの細胞が実験に使用できつつあった。各種代謝酵素やトランスポーターが発現しているヒト肝細胞が使えるようになったことで、肝臓からの薬物消失能力の予測精度が格段に進化したといえる。腎臓でも同様にヒトの腎スライスを用いた実験が可能であったが、消化管ではヒト小腸細胞を用いた実験系がないことに気付いた」と消化管の研究に興味を持った理由を述べる。
現在、製薬企業などが消化管からの薬物吸収性予測を行うときの標準的な方法は、動物実験か、ヒトの大腸がん由来不死化細胞であるCaco-2細胞を用いた実験である。それぞれ、一長一短があるが、例えば動物実験ではヒトと動物との種差が問題となる。
「多数の薬で、サル、げっ歯類、イヌとヒトのバイオアベイラビリティを比較した研究により、ヒトと動物のバイオアベイラビリティは必ずしもあまり良好には一致しないことがわかっている」と前田教授は言う。
一方、Caco-2細胞は扱いやすいという利点があるが、大腸がん由来の細胞であることから、「ヒトの正常な小腸細胞とはトランスポーターや代謝酵素の発現量などに違いがある」と指摘し、「Caco-2細胞は、複数の取り込みトランスポーターの発現量が一律に低く、特に医薬品の約半数の代謝を担う代謝酵素CYP3A4の発現は非常に低い」と説明する。こうしたことから、前田教授はヒト小腸の機能をより直接的に反映可能な実験系として、ヒト検体を使う方法を模索するようになった。
だが、ヒト小腸の組織や細胞は入手困難だった。前田教授は、手術時に破棄される残余検体を入手することを思い立ち、「正式にこのプロジェクトを立ち上げたのは2019年だが、その6年ほど前から全国の消化器外科の先生方を訪ね歩いて、検体の提供をお願いして回った」という。
とはいえ、さまざまなハードルがあって手術残余検体の入手はなかなか実現しなかった。まず、患者さんの臓器・組織の提供が新薬開発に貢献することへの理解を得て、関係諸機関の倫理審査の手続きを踏まなければならない。また、採取から時間がたつと、消化管組織に発現するトランスポーターや代謝酵素の機能が著しく低下してしまうため、短時間で処理して提供してもらう必要があり、手術室の医療スタッフの手を余計にわずらわせることになる。紆余曲折の末に巡り会ったのが、筑波大学消化器外科の小田竜也教授であり、膵臓がんの膵頭十二指腸切除術において切除される正常な小腸上部の組織を、阻血時間を最小限に抑えて提供してもらえることになった。
「小田先生の多大なる協力によって、極めて新鮮度の高いヒト消化管組織を、国際的にも例を見ない月1~2例という高い頻度で入手できるようになった」と前田教授は強調する。
こうして、前田教授らは手術残余小腸検体を用いた薬物透過性評価の実験系構築に取りかかった。当初、試みたのは、1㎠ほどに切断した消化管組織断片をチャンバーの間に挟み、さまざまな化合物の組織片を介した透過を観察することで、消化管吸収・分泌能を評価する方法であった。この方法により、トランスポーターの基質性の有無に関わらず統一した実験系でヒトにおける消化管吸収率の予測が可能であることを2021年に論文発表した。しかし、同時に短所として「検体採取後、時間とともに各種トランスポーターの機能が落ち、4時間後にはほぼ半減してしまう」ことも明らかになった。手術残余検体がいつ入手できるか正確にわからない上に、実験の実施に長時間かかることを考えると、創薬の過程でルーチンに活用するのは難しく、別の方法が必要と考えられた。
そこで、前田教授らは手術残余小腸検体から採取した小腸幹細胞の3Dスフェロイド培養を実施、凍結保存し、必要なときに2次元の培養系に展開し、吸収上皮細胞に分化させることで細胞透過実験に用いる方法を開発した。ヒトや動物のcrypt(消化管絨毛の根元)領域に存在する小腸幹細胞を継代培養し、それを分化させる技術は再生医療の研究者たちによってすでに確立されている。それを薬物動態研究にも活用できるのではないかという着想の下で始まった実験系であり、「げっ歯類からヒトに至るまで、ほぼ同じプロトコールで培養し、実験条件の違いに左右されずに結果を比較することができるため、消化管吸収の種差やその原因も調べることにも活用可能」という点が強みとなる。前田教授らは、すでにマウス、イヌ、サル、ミニブタで小腸と大腸の計6部位、ヒトの小腸上部・下部でそれぞれスフェロイド株を複数ロット樹立している。
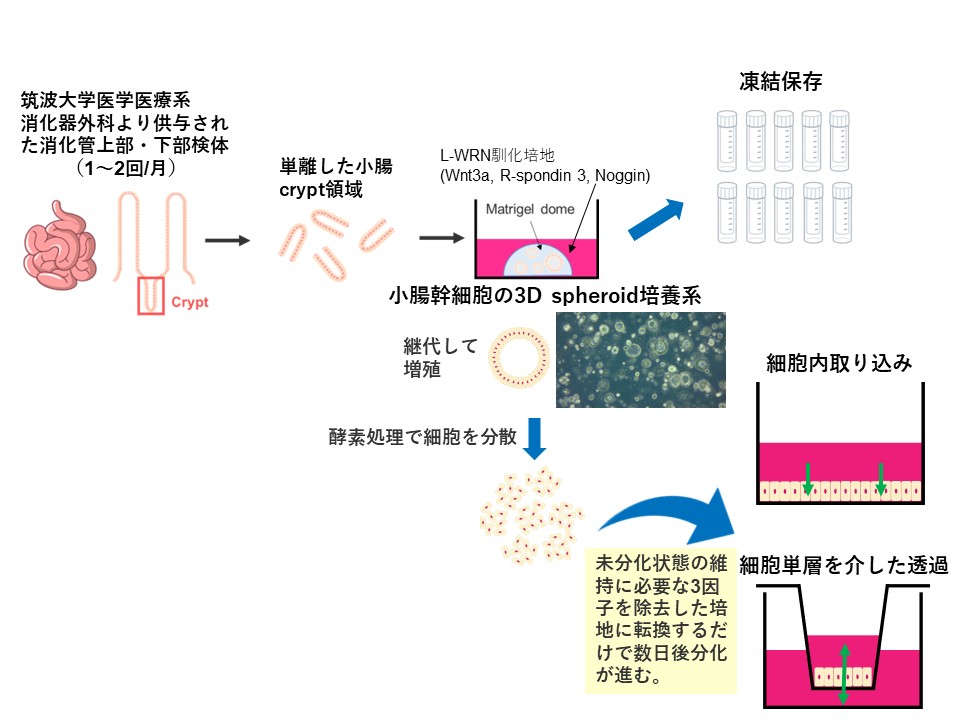
また、このヒト小腸crypt由来分化細胞は、cryptを採取した部位の遺伝子発現パターンを分化細胞が保持するといった特徴もある。同じ小腸でも、上部、中部、下部といった領域によって薬物の吸収に関わる代謝酵素・トランスポーターの発現量が異なるといわれていたが、その機能差をin vitro実験で証明できる実験系には限りがあり、特にヒトにおいては皆無であった。前田教授は「おそらく、この実験系によって薬物吸収に関する消化管の領域差が明らかになっていくだろう」と期待を口にする。例えば、前田教授らが行った実験では、胆汁酸のトランスポーターであるASBTは小腸下部で、葉酸のトランスポーターであるPCFTは小腸上部で特に多く発現していることが、今回樹立したヒト小腸crypt由来分化細胞を使った実験で確認されている。
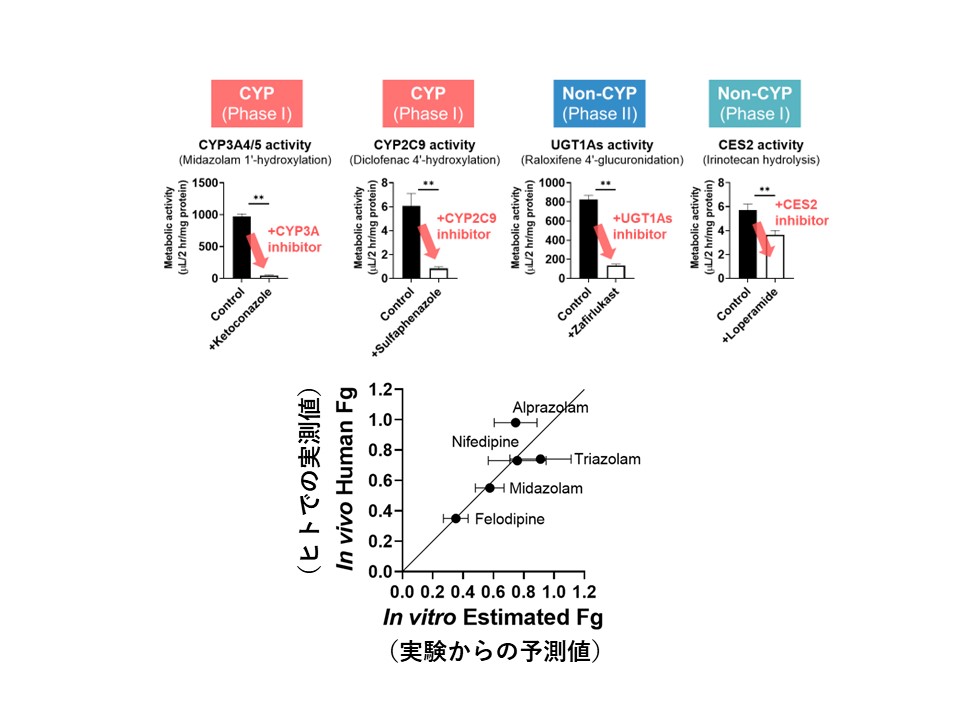
また、前田教授らは、本実験系において、様々な種類の代謝酵素活性が確認できること、さらには、従来のCaco-2細胞では発現量が極めて低いため消化管吸収に与える影響を評価できないCYP3Aによる代謝について、代謝速度が異なる複数の薬物を用いて、ヒトにおける消化管吸収率を簡単な数式を介して良好に予測することに成功し、本実験系ならではの特性を活かした吸収評価を実施している。
さらに、前田教授らはヒト小腸由来細胞を薬剤誘導性の消化器毒性の予測に応用する研究にも着手している。例えば、EGF受容体チロシンキナーゼ阻害薬には、下痢の副作用があることが知られているが、その頻度は薬剤の種類ごとに違う。ヒト小腸幹細胞スフェロイドを用いた実験では、消化管の副作用頻度が高いとされる薬剤では、比較的低濃度域から細胞のATPレベルが著しく低下し、高濃度域では細胞死の指標であるLDHの細胞外への放出が急激に高まることが示され、薬剤ごとの差がin vitro実験でもある程度再現できたという。
「われわれの実験系により、野生型/変異型EGF受容体への阻害選択性の高さ、EGF受容体の阻害が可逆的なのか不可逆的なのかなどの違いによっても、消化管毒性に差が出うる可能性が示唆された。一方で、旧来から創薬に繁用されてきたCaco-2細胞の実験系では毒性に対する感受性が極めて低いことが確認され、われわれの実験系は、新たな薬剤誘導性消化器毒性の強度比較やメカニズムの推定において有用性が示されるものと考えている」と前田教授は述べ、「今後は、消化管のトランスポーター発現の個人間変動や遺伝子変異の影響なども加味した、より分子レベルの研究も進め、精度の高い薬物吸収性、消化器毒性予測システムの確立を目指したい」と続ける。
創薬応用への課題は、ヒト検体入手の困難さだ。「創薬を推進する施策の一つとして、国全体で様々なヒト組織検体を有効活用可能な体制づくりを進めるべきだと考える。例えば、病院と直結した新鮮な組織にアクセス可能な臓器・細胞バンクの構築、医療従事者・組織バンクと創薬研究者間の緊密な情報共有による真の創薬ニーズを満たすヒト組織の供給と利活用法の開発などが非常に重要になるだろう」と前田教授は話している。


