糖鎖を標的とした新たな治療薬の開発に期待
岐阜大学糖鎖生命コア研究所の木塚康彦教授らの研究グループは7日、同研究所鈴木健一教授、大阪国際がんセンターとの共同研究で、がんに関わる糖鎖が作られる新たな仕組みを発見したと発表した。
GnT-Vは糖鎖を作る酵素で、作られた糖鎖はがんを進行させることが知られている。同研究で、GnT-Vはがん細胞が放出する細胞外小胞に存在しており、この小胞がそのまま別の細胞に受け渡されることがわかった。
小胞を受け取った細胞は、GnT-Vが作るがんタイプの糖鎖を新たに作るようになるため、小胞上の酵素の受け渡しを介して細胞の糖鎖が改変されることが明らかになった。
同研究により、糖鎖の合成を調節する新たなメカニズムの解明や、細胞外小胞を介してがんが進展するメカニズムの解明への貢献が期待される。これらの研究成果は、2022年12月5日付で、国際学術誌『iScience』に掲載された。
糖鎖とは、グルコースなどの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、多くはタンパク質や脂質などに結合した状態で存在している。動物では、体内の半数以上のタンパク質に糖鎖がついていると考えられている。
タンパク質についている糖鎖にはさまざまな形のものがあり、タンパク質ごとに形が異なることや、同じタンパク質でも、健康なときと病気のときとで糖鎖の形が変化することが知られている。
こうした疾患特異的な糖鎖の変化は、実際に医療の現場でがんの診断などに使われている。また、特定の糖鎖が、糖尿病、がん、アルツハイマー病などさまざまな疾患の発症や進行に重要な役割を果たすため、糖鎖を標的とした新たな治療薬の開発が期待されている。
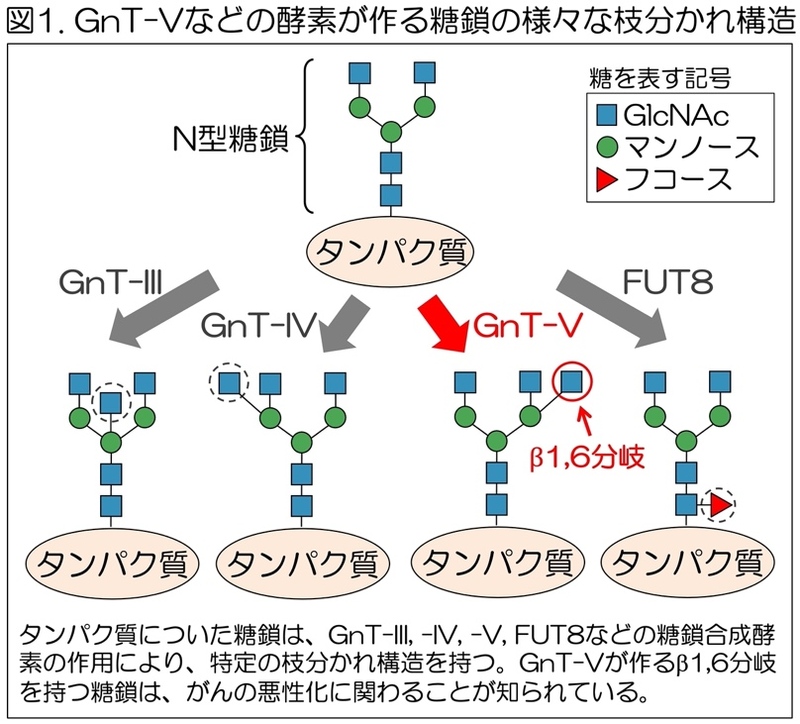
タンパク質につく糖鎖は、細胞の中で糖転移酵素(糖鎖合成酵素)と呼ばれる酵素の働きによって作られる。180種類ほど存在しているヒトの糖転移酵素のうち、GnT-Vなどの酵素は、細胞の中で、タンパク質についたN型糖鎖と呼ばれる糖鎖に作用し、糖鎖の特定の枝分かれ構造を作る(図1)。
特に、GnT-Vが作るβ1,6分岐構造を持った糖鎖は、さまざまながんでその量が増大し、GnT-V欠損マウスでがんの増殖・転移が抑制されるため、がんの進行・転移などに関わることが知られている。さらに、GnT-Vが多いがん患者では予後が悪くなる傾向を示すため、GnT-Vはがんの治療標的の一つと考えられている。
その一方で、GnT-Vが作る糖鎖ががんで増える仕組みや、がんの転移に関わる詳細な分子メカニズムについてはまだ十分にはわかっていない。
近年、細胞が分泌するエクソソームなどの細胞外小胞にさまざまな生体分子が含まれており、それらの小胞が別の細胞に取り込まれて生体分子が受け渡され、細胞同士が情報を伝達していることがわかってきた。この情報伝達の仕組みは、がんの転移にも深く関わると考えられている。
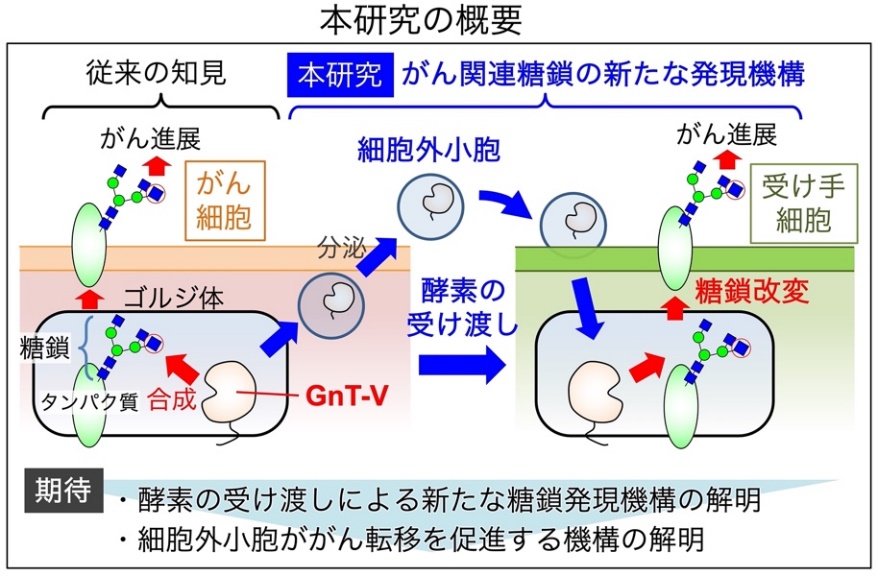
一方、細胞外小胞を介した情報伝達と糖鎖の発現制御の関係はまだほとんどわかっていない。そこで、木塚教授らは、「細胞外小胞に糖転移酵素が含まれ、それによって小胞を受け取った細胞の糖鎖が改変される」という新たな糖鎖発現メカニズムがあるのではないかと仮説を立て、その可能性を検証した。
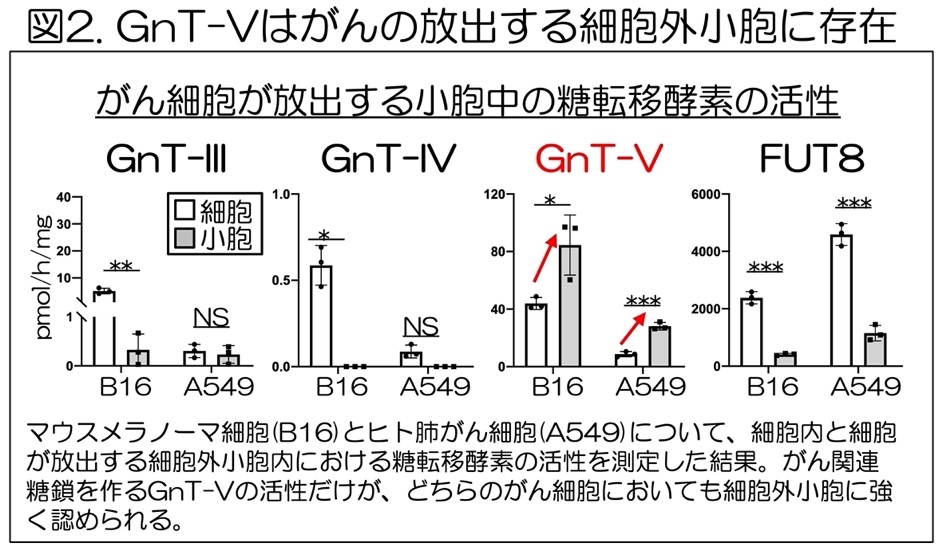
まず、がん細胞が放出する細胞外小胞を集め、その細胞とそこから放出される小胞とで、それぞれの中に含まれる糖転移酵素の活性を測定した。
その結果、GnT-III, GnT-IV, FUT8といった糖転移酵素の活性は、細胞中には含まれていたが、それに比べて細胞外小胞に含まれる量は極めて少ないことがわかった。
他方、がん関連糖鎖を作 るGnT-Vでは、調べた全てのがん細胞において、細胞中よりも小胞中に高い活性が検出された(図2)。この結果から、がん細胞が放出する細胞外小胞には糖転移酵素が存在し、特にGnT-Vが多く含まれていることがわかった。
次に、GnT-Vを含む細胞外小胞が別の細胞に取り込まれることによって、GnT-Vが細胞間で受け渡されるかどうか調べた。GnT-Vを産生するがん細胞(B16/GnT-V)から分泌される細胞外小胞を回収し、これをGnT-Vを欠損させた別の細胞に取り込ませました(図3A)。
その後、小胞を受け取った細胞のGnT-Vの酵素活性を調べたところ、小胞を受け取っていない細胞や、GnT-V量が少ない細胞(B16)由来の小胞を受け取った細胞では、GnT-Vの酵素活性は検出されなかった。
一方で、GnT-V量が多いB16/GnT-V由来の小胞を受け取った細胞では、GnT-Vの酵素活性が検出されることがわった(図3B)。同結果より、がん細胞が分泌する小胞の中のGnT-Vは、別の細胞に受け渡された後も活性を保っていることが判明した。
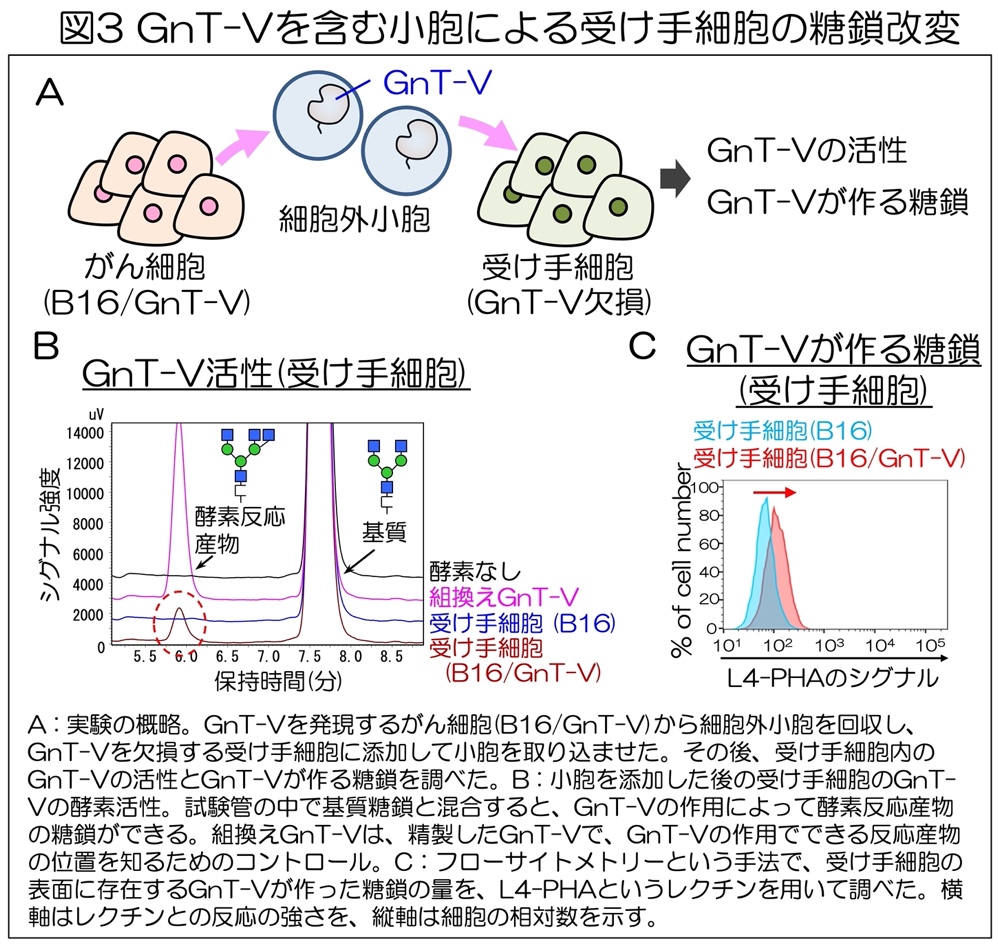
さらに、GnT-Vを含む小胞を受け取った細胞の糖鎖ががんタイプの糖鎖に変化しているかどうかを、レクチンを用いたフローサイトメトリーという手法によって調べた。L4-PHAは、GnT-Vがつくる糖鎖と特異的に結合するレクチンであり、このレクチンとの結合の強さを見ることで、GnT-Vが細胞内でどの程度糖鎖を作っているのかを調査できる。
その結果、B16/GnT-V由来の小胞を受け取った細胞では、L4-PHAとの結合性が増加し(図3C)、GnT-Vが作る糖鎖の量が増加した。
これらの結果から、がん細胞が分泌した細胞外小胞に存在するGnT-Vは、活性を保ったまま別の細胞に取り込まれ、その細胞内で新たに元のがん細胞と同じタイプの糖鎖を作る可能性が示された。
同研究により、糖転移酵素が小胞を介して別の細胞に受け渡されることが判明した。同発見は、糖転移酵素が取り込まれた先の細胞で活性を発揮し、細胞の糖鎖を改変する可能性を示しており、これまで知られている直接的な遺伝子発現を介さない、「酵素タンパク質獲得型」とも言える新たな糖鎖改変機構の存在を示唆している。
さらに、GnT-Vが作る糖鎖は、がんの転移と密接な関係があるため、同研究で明らかになった仕組みは、糖鎖ががん転移を制御する仕組みの解明にも貢献するものと期待される。
なお、同研究は、平成30年度から始まった科学技術振興機構(JST)の戦略的創造研究推進事業CREST課題『高精度1分子観察によるエクソソーム膜動態の解明』(JPMJCR18H2)の支援のもとで行われた。


