
MPS(Micro physiological Systems:生体模倣システム)はマイクロサイズのデバイスと培養細胞を組み合わせて臓器や生体の機能を模倣するシステムで、特に肝臓や小腸の機能を模したMPSモデルは医薬品の薬効や毒性、薬物動態を評価する創薬支援ツールとして期待されている。しかしMPSデバイスに比べ、MPSに搭載する細胞に関しては開発の遅れも指摘されてきた。
大阪大学大学院の水口裕之教授(薬学研究科・分子生物学分野)はヒトiPS細胞などからMPS搭載に最適な要件を備えた肝細胞と小腸上皮細胞の開発に挑み、独自の培養技術を用いて本物の細胞と同等の形状や薬物代謝活性を有する細胞を効率的に分化誘導することに成功。さらにMPSを用いたin vitro医薬品評価系の実用化を目標に研究を進めている。
水口教授が取り組んできた研究の原点は遺伝子導入に用いるベクター開発であり、特にアデノウイルスベクターの研究を25年以上継続してきた。その応用研究の一つが、ベクター技術を用いて細胞の分化を制御する研究で、2008年から独立行政法人医薬基盤研究所(現在の国立研究開発法人医薬基盤・健康・栄養研究所、大阪府茨木市)でヒトiPS細胞から肝細胞や小腸上皮細胞を分化誘導し、創薬に応用するスーパー特区研究プロジェクトをスタートした。
水口教授は「ヒトiPS細胞から、いかにして本物の肝細胞や小腸上皮細胞に近い細胞を作るのかを研究テーマとしてきたが、その背景にはヒトの肝細胞や小腸上皮細胞が入手しにくく、入手できる初代培養細胞は継代培養が難しくて高価であり、培養中に機能低下するといった問題があったからだ。iPS細胞から分化誘導した細胞に置き換えることでこれらの課題克服を目指した」と当時の状況を振り返る。特に肝細胞、小腸上皮細胞を医薬品評価に用いる場合は、薬物酵素活性やトランスポーター活性がin vivoの細胞と同等であることが求められる。
ヒトiPS細胞から肝細胞への分化は、未分化iPS細胞―内胚葉―肝幹前駆細胞―成熟肝細胞へと3~4週間かけて分化するプロセスをたどるが、それぞれの段階で適切な増殖因子やサイトカインなどの液性因子を加えて分化を誘導する。しかし、それだけでは質の高い細胞を効率良く作製することができなかったため、水口教授らはこのプロセスの中でアデノウイルスベクターを用いて細胞分化に関係する転写因子を導入し、強制的に分化を促進する方法を試みた。その後、ウイルスベクターを用いることなく、外部環境因子の調整だけで高品質なヒトiPS細胞由来肝細胞が効率的に作製できる技術も確立。同プロジェクトによって生み出されたヒトiPS細胞由来肝細胞は、初代培養肝細胞と同等レベルの薬物代謝酵素活性(CYP3A4、CYP2C19、CYP2D6など)や肝毒性感受性があることが確認され、2015年から市販されている。2019年にはヒトiPS細胞由来小腸上皮細胞も市販された。
このプロジェクトで培った経験を踏まえて、水口教授はMPSデバイスへの搭載を前提とした肝細胞、小腸上皮細胞の研究に注力するようになった。MPSに搭載する細胞系には、①均一な細胞を大量に調製できること、②分化細胞をMPSデバイスに播種するために継代培養が可能であること、③生体に近い薬物代謝酵素とトランスポーターの活性を有すること、④汎用性向上の面から凍結保存が可能であること――といった要件が求められるが、水口教授は「ここ1~2年のオルガノイド培養をはじめとする培養技術の進歩により状況は一変している」と強調する。
水口教授らは、まず未分化ヒトiPS細胞から種々の液性因子を段階的に組み合わせて、肝細胞への分化を行った。加えて、分化誘導した成熟肝細胞をオルガノイド培養の手法を用いて3次元的に培養し、それを再び2次元の平面培養に戻す独自の培養法を開発した(図1)。
オルガノイド培養することで、ヒトiPS細胞由来肝細胞の自己増殖および継代培養が可能になり、細胞機能のばらつきが小さく、MPS搭載に適したヒトiPS細胞由来成熟肝細胞が安定的に大量に作製できるようになった」と水口教授。
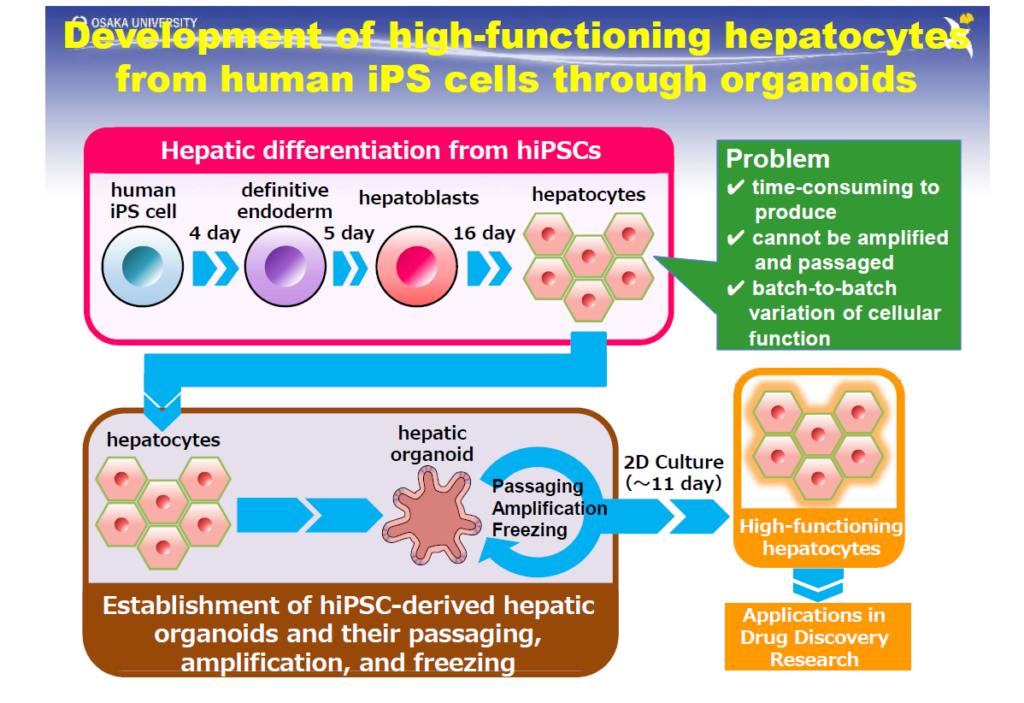
分化誘導した成熟肝細胞をオルガノイド培養してから平面培養に戻す
また、小腸上皮細胞についてもヒトiPS細胞から成熟した高機能な小腸上皮細胞に分化させる研究に取り組み、肝細胞の場合と同様に未分化iPS細胞―内胚葉―小腸前駆細胞―成熟小腸上皮細胞のプロセスの最適化と、成熟小腸上皮細胞をいったんオルガノイドとして3次元培養・増幅し、2次元培養に戻すことにより、MPSに利用できる単層膜の小腸上皮細胞を作製することに成功した。
水口教授は「オルガノイドはゲルに包埋された状態で増殖させるため、そのままでは薬剤を添加しても浸透しにくいといった問題点があった。小腸上皮細胞の場合は単層膜にする必要もあり、いったん形成したオルガノイドを分解して平面培養に戻すために、新たな培地を開発するなどの工夫を重ねた」と説明する。
オルガノイド培養技術は臓器から採取した細胞の培養にも応用できるため、水口教授らは生体臓器から採取した少量の小腸上皮細胞をオルガノイドとして培養した後、分解して2次元培養に戻す方法を試みたところ、この方法で作製した小腸上皮細胞は細胞表面の微絨毛の形成やCYP3A4の発現、細胞同士のタイトジャンクションによる単層膜形成など、小腸上皮細胞に必要な形状や機能を十分に備えていることが示された。
水口教授はさらに研究を重ね、「われわれが開発した方法を用いると、小腸ならヒトiPS細胞と臓器から採取した細胞から、肝臓ならヒトiPS細胞と市販の凍結ヒト肝細胞から高機能で十分な量の成熟細胞が培養でき、MPSに搭載できるようになってきた」と述べる。
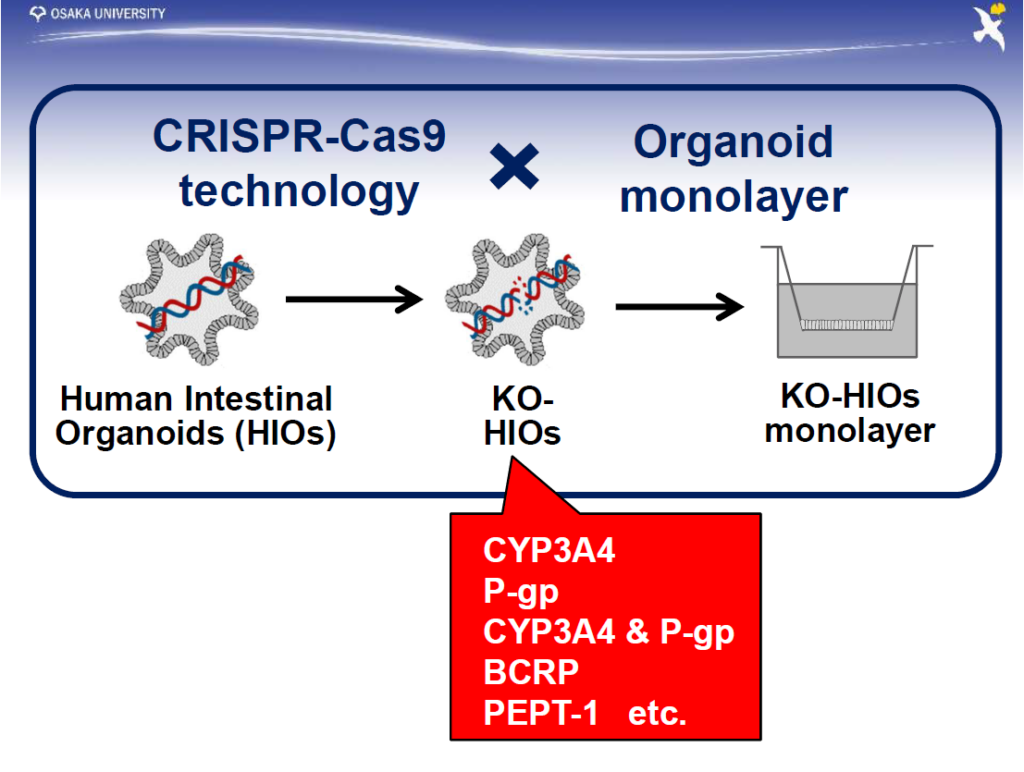
ゲノム編集とオルガノイド培養の技術で、特定の薬物代謝酵素、トランスポーターをノックアウトした細胞を作製
だが、水口教授はこれで満足することなく、さらに医薬品評価系としての付加価値を高める研究に取り組む構えだ。例えば、肝臓や小腸で重要となる薬物代謝酵素やトランスポーターの遺伝子を1つずつノックアウトした細胞ライブラリーを構築することにより、毒性や薬物動態を詳しく評価できるようになる(図2)。
また、小腸は近位部から遠位部まで各部位で代謝酵素やトランスポーターの発現が異なるとされるが、異なる部位から採取した細胞を培養することにより、それらを反映した評価系を構築することも考えられるという。
水口教授は「細胞培養は、iPS細胞、オルガノイド、ベクター、ゲノム編集などの最先端技術を組み合わせ、in vivoの本物の細胞とほぼ同等のものが調製できるようになってきた。若い研究者の参画を期待するとともに、製薬企業等のユーザーからご意見をいただき、より良い評価系の構築を目指したい」と話している。


