アルツハイマー病治療戦略の応用に期待
東京都立大学理学研究科の安藤香奈絵准教授らのグループは、新型コロナウイルスSARS-CoV-2から神経細胞死を抑制するペプチドを開発した。同研究成果は、アルツハイマー病治療戦略の応用に期待される。
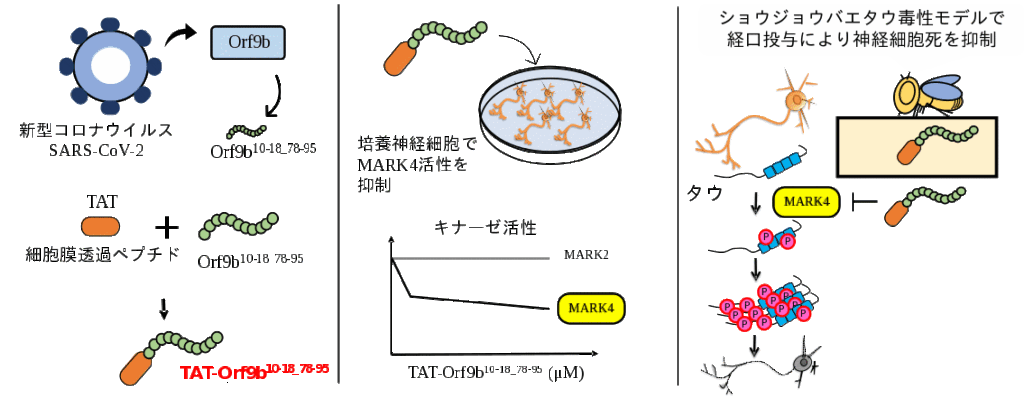
新たなMARK4の活性阻害ペプチドTAT-Orf9b¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵(Orf9bの10から18番目のアミノ酸と78から95番目のアミノ酸を繋いだペプチド)を開発したもの。Orf9bは新型コロナウイルス(SARS-CoV-2)のタンパク質の一つで、MARK4と結合させると、その活性を阻害することがわかった。
そこで、人工合成できるように最小限の配列を同定し、さらに細胞内に取り込まれるように細胞膜透過ペプチド(TAT(注2))を付加したペプチドのTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を作成した。このペプチドを培養神経細胞の培地に加えると、MARK4の活性が阻害された。
一方、よく似たキナーゼであるMARK2の活性は阻害しなかったことから、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ はMARK4に特異性が高いことがわかった。さらに、アルツハイマー病のモデル動物(ショウジョウバエ)にTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵を経口投与したところ、タウによる神経細胞死が抑制された。
同研究によって作成されたMARK4に対する特異的な活性阻害ペプチド(TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ )の応用により、将来、MARK4を標的としたアルツハイマー病の治療法の開発につながる可能性がある。なお、同研究成果は、10月24日付けでNeurobiology of Disease誌に掲載された。
認知症の一つであるアルツハイマー病では、脳内の神経細胞が死ぬことによって、記憶障害や運動障害が起こるが、その原因の一つに「タウ」と呼ばれるタンパク質の蓄積がある。タウは本来、神経細胞内の細胞骨格である微小管の安定性の維持を担っているが、疾患脳では本来の機能を失い、凝集して蓄積してしまう。
また、微小管親和性調節キナーゼ4(MARK4)がアルツハイマー病でタウの異常を引き起こすと考えられているが、そのMARK4を阻害することによってタウの蓄積を減少させ、毒性が緩和するとモデル動物で報告されている。
従って、MARK4の阻害剤はアルツハイマー病の治療薬となる可能性があり、注目されている。だが、MARK4に似たキナーゼは多く、特異性の高い阻害剤の開発が求められている。
微小管結合タンパク質タウは、アルツハイマー病などの神経変性疾患脳で蓄積し、神経細胞死を引き起こす。通常、タウは神経細胞の軸索で微小管の安定性を制御するが、疾患脳では過剰にリン酸化され、生理機能を失い凝集している。
タウをリン酸化する酵素は多くあるが、その中でもMARK4は、疾患脳でその活性が上昇することや、その変異がアルツハイマー病リスクを増加させるなど、発症機構への関与が示唆されている。
モデル動物では、MARK4の阻害によってタウによる神経細胞死を抑制できることが報告されており、MARK4の阻害は治療戦略として注目されている。
MARK4は、多くの生物で重要な役割を担うPar-1ファミリーの一員で、哺乳類にはよく似たファミリーメンバーとしてMARK1,2,3,4がある。
これまでに報告されているMARK4阻害剤は、基質と競合することでその活性を阻害するが、基質を認識する部位はファミリー分子の間でよく似ているため、MARK4以外のファミリーメンバーも阻害してしまう可能性があった。他のファミリー分子の生理機能を阻害せずにMARK4のみを阻害するという、MARK4への特異性の高い阻害剤が求められていた。
同研究では、新型コロナウイルスの構成タンパク質の一つであるOrf9bが、MARKファミリーと相互作用することに注目し、Orf9bの配列から、MARK4を阻害するペプチドを開発した。
Orf9bを哺乳類培養細胞に発現させて、MARK4の活性への影響をタウのリン酸化を指標として調べたところ、タウのリン酸化が阻害されることが判明した。
次に、タウの毒性への影響を調べるため、ショウジョウバエモデルを用いた。ヒトのタウをショウジョウバエの視神経細胞に発現させると細胞死が起きるが、そこにOrf9bを共発現させると、タウのリン酸化が減少し、タウによる神経細胞死が抑制されていた。
Orf9bは、全長97アミノ酸であり、全長を人工合成するのは難しい。合成しやすいようにできるだけ短くするため、MARK4の阻害に必要な最小限の領域を探した。
構造予測ツールとOrf9bの機能的な情報から、Orf9bの10から18番目、78から95番目のアミノ酸を繋いだペプチド(Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ )を合成したところ、MARK4の活性阻害に十分であることを見い出した。
Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ のMARK4活性阻害パターンを調べると、濃度非依存的にMARK4の活性を阻害していたことから、Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、MARK4の基質認識部位と異なる領域に結合して立体構造を変化させるアロステリック阻害であることがわかった。
アロステリック阻害剤は、競合阻害剤より一般に特異性が高い。調べてみると、Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は同じファミリーメンバーのMARK2の活性は阻害せず、MARK4への特異性が高いことがわかった。
さらに、細胞外から加えられるよう、TATを付加したTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を作成した。TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、培養神経細胞に取り込まれ、MARK4によるタウのリン酸化を阻害した。
加えて、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を、ヒトのタウを発現するショウジョウバエに経口投与すると、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は脳内に取り込まれ、視神経細胞に発現させたタウのリン酸化を抑制し、タウの毒性を緩和した。
同研究で開発したMARK4の新たなペプチド阻害剤TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、細胞膜を透過してMARK4の活性を阻害することで、タウの異常リン酸化を抑制し、タウによる神経細胞死を緩和した。
今後、さらなる改良により、アルツハイマー病の治療薬の開発につながる可能性がある。またMARK4の異常な活性化は虚血による軸索損傷、炎症、心疾患、癌や糖尿病への関連も示唆されており、それらの疾患の治療にも役立つ可能性がある。


