
肝臓などの臓器表面から抗がん薬を直接投与し、腫瘍のある部分を狙い撃ちする―このような新しい投与形態のドラッグデリバリーシステム(DDS)の研究を進めているのが、長崎大学大学院大学院医歯薬学総合研究科の西田孝洋教授(薬剤学分野)だ。
長崎大学の薬剤学研究室は「表面投与班」「動態班」「遺伝子班」に分かれて活動しているが、「研究室の目標である『薬物治療の最適化』に向かって、それぞれの研究成果を互いに活用しつつ、三位一体で研究を展開している」と西田教授は述べる。自身の研究テーマが「臓器表面からの直接投与」であるが、その着想を得たきっかけは「京都大学の大学院生時代に行った肝臓の灌流実験中に、露出させたラットの肝臓に門脈から注入した薬物が一様に分布するさまを見て、『この肝臓の表面から薬を吸収させた方が到達力は高いのではないか』と素朴な疑問を持ったことだった」と振り返る。動物実験の麻酔が一般的に腹腔内注射で行われていることからも、腹腔内臓器表面からの投与法は実現の可能性があると考えたという。
長崎大学に移ってから、西田教授は本格的に臓器表面への直接投与の研究を開始した。1994年に自身で設計した内径9㎜の円筒型ガラス製デバイスを用いて動物の肝臓表面にマーカー物質を滴下すると、2時間後にはデバイス直下の部分だけに集積している様子が観察できた。また、胆汁からマーカー物質が多量に検出され、「臓器表面には当初、想定していた以上に大きな吸収力があることが分かった」と説明する。
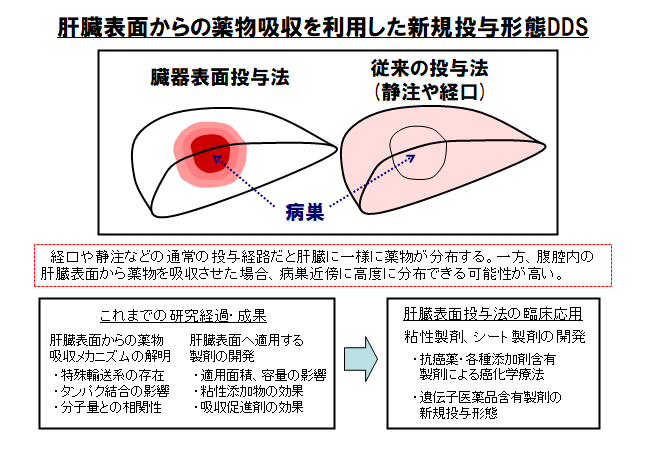
西田教授らは、肝臓表面から吸収できる分子量、吸収速度などの薬物動態研究、肝臓表面から薬物が吸収されるメカニズム(輸送系、タンパク結合など)の解明、肝臓表面に適用する製剤開発などの研究を進めた。現在は基礎的なデータが出そろい、実際に抗がん薬を含有した特殊製剤を用いて、肝臓表面からの直接投与の動物実験を行っている段階にある。
2017年には、先に開発したデバイスを用いて、担がんラットの肝臓表面から抗がん薬5-FUを直接投与した研究結果の論文を発表したが、投与デバイス直下(左葉)、デバイス直下以外の外側左葉、非投与葉(右葉)のそれぞれの組織を採取して、分布した薬剤濃度を比較すると、5-FUは投与デバイス直下だけに極めて高く集積し、他の部位の濃度は極めて低いことが示されている。
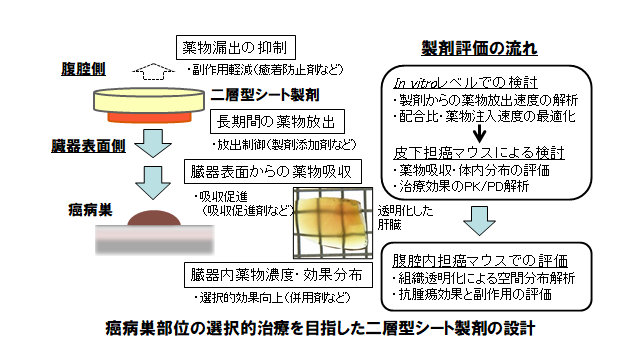
次の段階で取り組んだのが製剤化研究である。西田教授は「肝臓表面に付着して、局所で長期に薬物を放出でき、何よりも抗がん薬の副作用が回避できる製剤でなければならない」と指摘し、肝臓表面での滞留性向上、放出制御、吸収促進など、さまざまな観点から研究を重ねた。
「薬剤が投与部位以外の腹腔内組織に付着して副作用を惹起する可能性を低減するという意味で、シート製剤が適していると考えられる」と西田教授。そのため、当初は抗がん薬を含ませた一層のシート製剤を開発したが、その後は抗がん薬含有層に漏出防止層を被せるような二層型シート製剤を設計し、実験を重ねている。放出制御、吸収促進のための添加剤などの工夫も行い、in vitroの実験では、二層型シート製剤を用いると14日目にも抗がん薬の高い放出性が得られることが確認できた。
最近の実験では、皮下担がんマウスに、二層型シート製剤によるドキソルビシン直接投与を行い、1週間後の腫瘍の縮小効果と各臓器への影響を測定したところ、薬剤の分布濃度は腫瘍部位で極めて高く、心臓・血漿において有意に低くなり、腫瘍の大きさは処置群が未処置群に比べて20分の1になったことが示され、論文化の準備を進めている。
抗がん薬の投与経路は、一般的な静脈注射、経口投与に加え、皮下注射、経皮吸収、直腸投与、臓器動脈への注入、腫瘍内注入、体腔内注入などの方法が実用化されている。西田教授らの研究が臨床応用されれば、新たな投与経路が加わることになるが、課題は臨床現場において、どのような方法で患者の臓器表面にアプローチするのかである。
この点については「内視鏡を用いて臓器表面に体内でゲル化する製剤を投与するのが一つの方法であり、もう一つは、がん切除手術の際、腫瘍を切除し終わった後の臓器にシート製剤を貼り付ける方法だ。後者はわざわざ新たな手術を行う必要がなく、シートが傷口の保護やがん細胞播種防止の役割も果たすので、より現実的だと考える」と西田教授。術後の化学療法に代わる治療選択肢の一つになるかもしれない。
臓器表面投与の研究過程では、同研究室「遺伝子班」、「動態班」の研究との相乗効果が生まれている。例えば、臓器表面からの遺伝子導入治療だ。遺伝子班は、臓器表面に摩擦を加えると遺伝子導入を行った際の発現効率が上がる現象を見い出し、歯磨き剤などに含まれる研磨剤である炭酸カルシウムを最適化し、花びら状になった「炭酸カルシウムマイクロフラワー」を開発し、臓器表面への新規遺伝子導入促進剤として特許取得している。 また、近年、組織内の遺伝子発現などを三次元的に可視化するために、組織を透明化する試薬が市販されているが、遺伝子班はオリジナルの試薬を開発した。2022年3月に特許公報された同試薬は、界面活性剤を含まないため生体膜を保持したまま短時間に透明化できるという特徴を持つが、二層型シート製剤の開発過程でも同試薬を用いて担がんマウスの肝臓組織を透明化し、空間的な分布を解析して効果と副作用の評価を行う予定だ。さらに、同研究室は臓器表面投与の研究過程で腹腔内の薬物吸収についても多くの実験を行ってきたが、「動態班」はそこから派生した新たな研究テーマ、腹膜透析における腹膜機能劣化予防薬の薬効評価に取り組んでいる。
一方、西田教授は実験を進める上での悩みとして「動物を用いたin vivoの研究はこれまで培った経験とノウハウで比較的うまく進めることができているが、細胞を用いたin vitroの研究は苦戦することも多い」と現状を述べ、「われわれがターゲットとしている肝細胞をはじめ、さまざまな細胞や試薬を扱うケー・エー・シーの事業には興味がある」と話している。
取材の最後に、西田教授は「私も含め、身近な人ががんと闘病する姿を見て、抗がん薬の副作用を減らしたいと思い、薬学を志した人は多いのではないか。副作用を減らせる臓器表面からの投与を必ず実用化したい」と決意を述べるとともに、「若い研究者には素朴な疑問を大事にして発展させることを心掛けてほしい。医療現場の医師や薬剤師には患者さんから得たニーズを研究につなぐ役割を果たしていただきたい」とメッセージを送った。


