
創薬や再生・細胞医療の分野で活用が期待されるMicrophysiological system (MPS=生体模倣システム)。東海大学の木村啓志教授(マイクロ・ナノ研究開発センター、工学部生物工学科・機械工学科)は、その基盤技術であるマイクロ流体デバイスの研究者で、「使いやすさ」や「汎用性」を重視したMPSデバイスの開発を進めている。
木村教授がもともと目指していたのはロボット工学の研究者。だが、まだ学部生だった2000年代初頭に登場したホンダの2足歩行ロボットが「大学の研究レベルを遥かに超えている」ことに衝撃を受け、別の道を模索した。
そこで出会ったのが、ロボット工学から転向してわが国におけるマイクロ流体デバイス研究のパイオニアとなった藤井輝夫教授(現・東京大学総長)である。当時は、世界的にマイクロ流体デバイスを用いて細胞を培養する試みが開始された時期であり、医療・創薬・生命科学にも興味を抱いていた木村教授は、藤井研究室でこの技術を応用したMPS開発を研究テーマとするようになった。
細胞培養については、同じ研究所に在籍していた酒井康行教授(現・東京大学大学院工学系研究科)の指導を受けた。「エンジンとモーターの“いいとこ取り”をして機能を高めたのがハイブリッドカーであるように、MPSも生物と機械をうまく組み合わせて機能を発揮するようなハイブリッドシステムを開発するというイメージで研究を続けてきた」と木村教授は話す。
マイクロ流体デバイスとは半導体微細加工技術によって作り出され、毛髪ほどのサイズの流路上で化学反応や計測などができる機能を有したデバイス(チップ)のこと。微小サイズのシステムであるため、処理の高速・高効率化や少ないサンプルで処理が可能といった効果が期待できる。
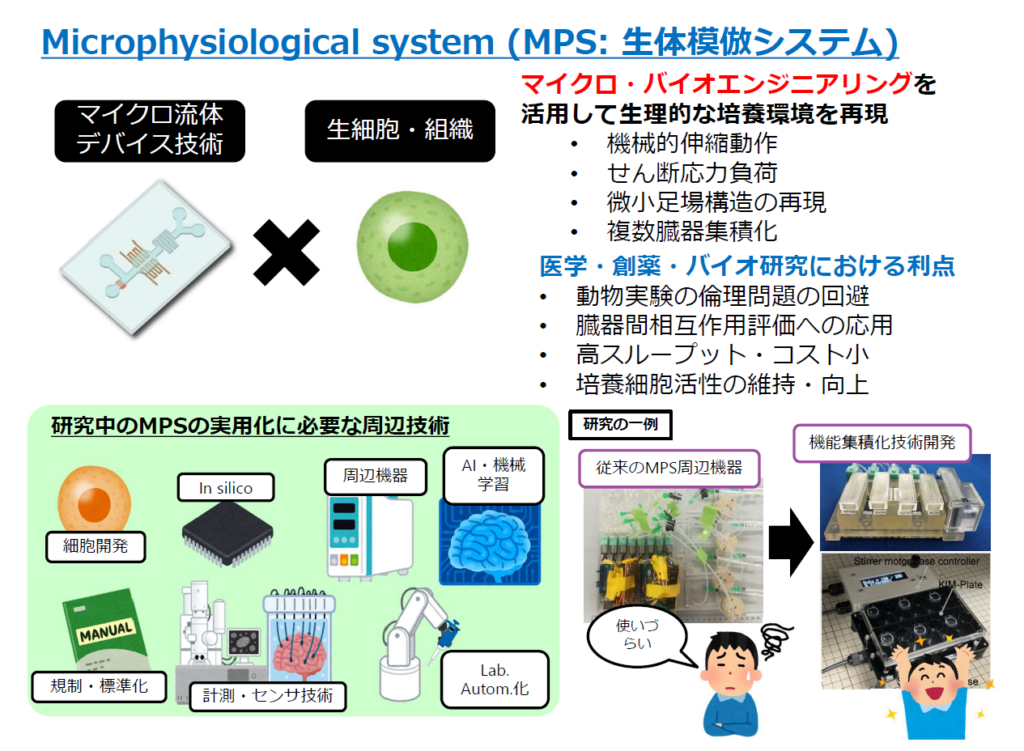
木村教授は工学研究者の立場から、マイクロ流体デバイスとヒト細胞を組み合わせたMPSは、①呼吸などの機械的動作の再現、②細胞のせん断応力(シェアストレス)の再現、③微小足場構造の再現、④複数臓器の集積化――など、従来の実験系では再現できなかった生理的環境が再現できると説明する。
その上で、創薬や医療技術開発においては「動物実験の倫理問題や種差問題の回避、臓器間相互作用の評価、実験の効率化とコスト削減、細胞活性の維持や向上などが期待できる」と続ける(図1)。
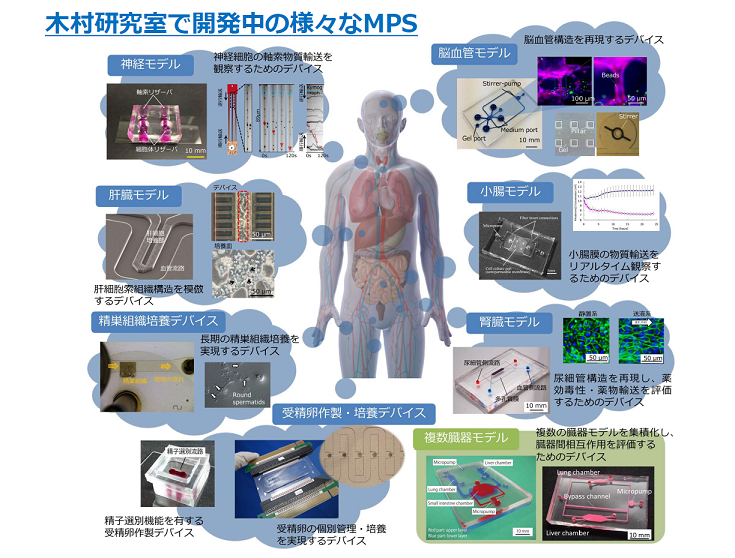
木村教授は多数の研究機関や企業とMPSの共同研究を進め、神経モデル、脳血管モデル、肝臓モデル、小腸モデル、腎臓モデル、精巣組織培養デバイス、受精卵作製・培養デバイスおよびそれらを組み合わせた複数臓器モデルなど、さまざまなMPSを開発中である(図2)。
それらは、薬物の毒性・効果・動態の評価、疾患の病態解明のほか、生殖医療への応用も視野に各分野で共同研究が重ねられている。臓器の構造・機能を体外で再現するMPSデバイスは、長期的な細胞培養が可能で薬物の添加やメンテナンスも容易であるという特徴を有するため、幅広い応用が考えられるという。
MPS開発で木村教授が重視するのは使いやすさ。2021年度に終了したAMEDの第1期MPS事業では、自身が関与した「Fluid3D-X(膜型臓器モデル)」と「オンチップポンプ型MPS(2臓器連結モデル)」が製品化検討段階まで進んでいるが、「誰でも使えるようなシンプルな構造を心掛けて開発した」と強調する。
だが、「マイクロ流体デバイスだけを開発しても使いやすいシステムにはならない」と木村教授は指摘する。実験に使用する際には、細胞を搭載するMPSデバイスの周囲にマイクロポンプ、培養液タンク、バブルトラップ、制御用マイコン、電源、それらをつなぐチューブや電線を配置する必要があり、準備作業は複雑になる。チューブに空気が流入して細胞を傷害するといったトラブルも起こりがちだ。
「実用化するには、周辺機器も含めた使いやすさの追求が必要」と気付いた木村教授は、マイクロ流体チップと周辺機器を1つのプラットフォームに集積化したシステムを開発した。これは実験器具の標準である96穴マイクロプレートと同サイズ(ANSI/SLAS規格)のMPSカセットの上に、マイクロ流体チップと種々の周辺機器を搭載するようにしたもの(図1・右下)。
煩わしいチューブ接続作業もなくなり、ANSI/SLAS規格に準拠したため種々の自動観察・分析装置、培養装置が使用できるようになった。規格化やラボ作業自動化のプロセスではロボット工学の知識が役立ったという。
木村教授が、もう一つ重視する要素に汎用性がある。酒井康行教授(前出)や企業と共同開発した「オンチップポンプ型MPS」は、ANSI/SLAS規格のプレート上に2つのチャンバ間を流路とポンプでつないだ灌流共培養ユニットを6セット搭載できるデバイス。それぞれのチャンバに肝臓と小腸などの異なった臓器細胞を、カルチャーインサートなどの市販の培養器具ごとセットするだけで、臓器間の連関が調べられる。
煩雑な作業が不要な上に、プレート上でさまざまな組み合わせの臓器細胞を使って実験ができる汎用性の高さが特徴であり、「例えば、腎臓と各種の臓器の連関を一度に調べるといった使い方ができるため、どのようなファクターが臓器間連絡に関与しているかなど、連関機序のさらなる解明につながるのではないか」と木村教授は期待を寄せる。
MPSは、5年ほど後には創薬プロセスで標準的に利用される技術になると期待されているが、「それまでには多くの周辺技術を開発していかなければならない。中でもMPSに搭載した際にも生体内と同等の機能を発揮する細胞の開発、機能を発揮させるための周辺技術開発が鍵になるだろう」と木村教授は話す。
また、MPSの新たな可能性を示す分野として注目されるのが生殖医療分野だ。木村教授は文部科学省の配偶子インテグリティ構築プロジェクトの一つとして精巣組織培養デバイス、受精卵作製・培養デバイスの開発に取り組んだが、「私の究極の目標は手塚治虫先生が『火の鳥』で描いた人工子宮の開発。何十年かかるか分からないが、体外受精の後、代理母に頼まなくても出産まで完結できる生殖医療の実現に貢献したい」と夢を語る。
木村教授は最後に「工学技術は応用先がなければ社会貢献できない。私が研究を進めることができたのは、さまざまな研究分野の共同研究者に恵まれて研究の種を見つけることができたからだ」と感謝の思いを口にした。


