腸管上皮細胞モデルなどを用いて、食品成分の作用を解析

群馬大学大学院教授の薩秀夫氏(食健康科学研究科・理工学府 理工学部・食品工学プログラム・食品機能学研究室)は、モデル細胞を用いた機能性食品成分の探索および解析研究を通じて、「食で病気を予防する」ことを目指す研究者だ。
「食品を開発する企業はそれぞれ独自の素材を有しているが、生体への作用やそのメカニズムを評価する適切な実験系を持たないことが多い。企業との共同研究で食品機能をより詳細な実験系を用いて評価することによって病気の予防に貢献したい」と薩氏は話す。
薩氏がこれまでに進めてきた食品機能研究の対象は、生活習慣病領域では腸管・腎臓のグルコーストランスポーターを抑制する食品成分、尿酸排出を促進する食品成分、生体防御能領域では免疫系を活性化しうるプロバイオティクス、腸管のバリア機能を増強する食品成分、皮膚領域では肌機能(保湿性、抗UV)を改善する食品成分、さらには中高年の記憶力の維持が期待される食品成分、分子・細胞レベルのタウリンの生理機能解析など多岐にわたる。
一例として、薩氏は腸管上皮のトランスポーターを抑制する食品成分開発について、こう説明する。「糖質はグルコースやフルクトースなどの単糖類に分解されて腸管から吸収されるが、グルコースは腸管上皮のトランスポーターであるSGLT1から、フルクトースはGLUT5から吸収されることが分かっている。腸管上皮細胞モデルを用いて、これらのトランスポーターの阻害作用を有する食品成分を見い出すことができれば、過剰な糖質吸収に起因する糖尿病や肥満を予防・改善できる可能性がある」。
薩氏が手掛けた食品成分機能評価系の中でも、ヒト腸管上皮細胞モデルは多くの成果を生み出してきた。薩氏は「腸管上皮は食品を吸収する機能だけでなく、脂溶性生体異物を排出するバリア機能、異物の刺激を受けて免疫系細胞のサイトカイン産生を誘導するシグナル誘導機能などを有している。私たちはこれらの機能を活性化あるいは抑制する食品成分を研究してきた」と述べる。
代表的な研究が、肥満と強い相関関係があるとされるフルクトースの腸管吸収阻害効果を有する食品成分を探索する研究だ。前述したようにフルクトースはGLUT5から吸収されることが分かっている。薩氏は腸管上皮モデルCaco-2細胞を用いて、数十種類の食品成分をスクリーニングした結果、「強い吸収阻害効果を示したのは、柑橘類に含まれるフラボノイドであるNobiletinとTangeretin、緑茶カテキンのECg(エピカテキンガレート)だった」という(図1)。
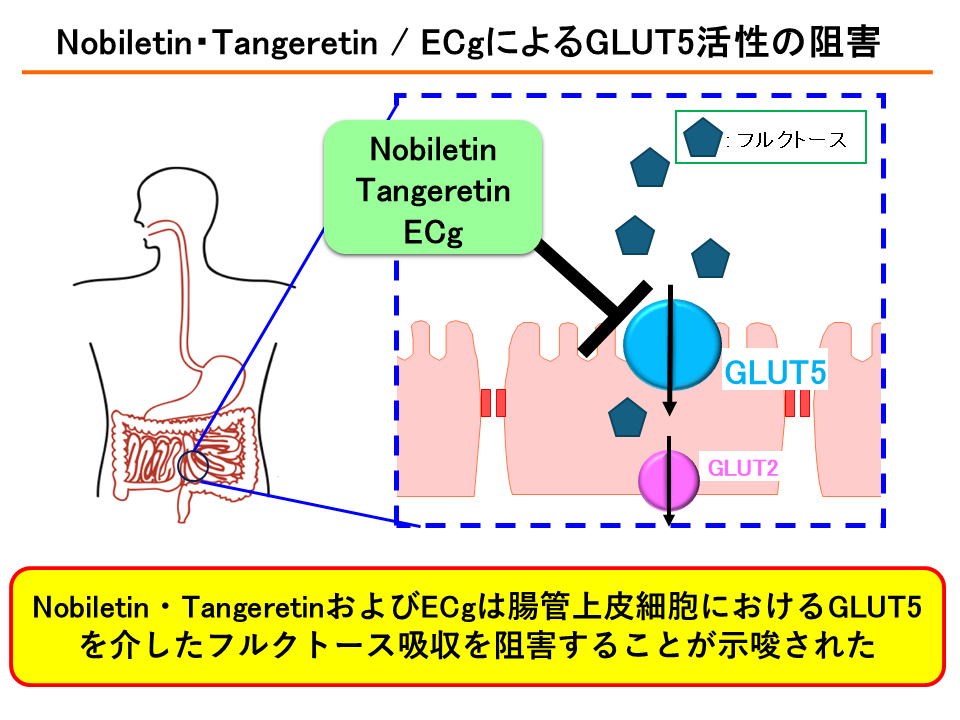
図1 フルクトースの取り込み活性を阻害する食品成分の探索研究
同研究に先立って、薩氏はグルコースの腸管吸収に関して、別の細胞腸管上皮モデルを用いて5種類の緑茶カテキンのSGLT1活性阻害効果を検証する実験を行っている。研究では緑茶カテキンの中でも、ECgとEGCg(エピガロカテキンガレート)がSGLT1活性阻害効果を示した。このことから薩氏は「ECgはグルコースとフルクトースの吸収阻害作用を併せ持つといえる」と話す。
先駆的な細胞共培養で腸炎症の複合的モデルを構築
腸管上皮細胞モデルを用いた研究の中でも、特にエポックメイキングな研究となったのは腸炎症の研究を行っていた2006年に、腸管上皮細胞と活性化マクロファージの共培養モデル系確立に成功したことだ。
「炎症性腸疾患のメカニズムとされる生体異物による刺激、腸管上皮でのIL-8産生、免疫細胞からのTNF-αや活性酸素放出による腸管バリアの損傷という炎症ループが、細胞モデルで再現できるのではないかと考えた」と薩氏は研究の発端を語る。
当初は腸管上皮細胞のみのモデルを用いて、TNF-αと活性酸素、さまざまな食品成分をふりかけてIL-8産生を抑制する成分を探索。特にコーヒーの中に多く含有されるクロロゲン酸がIL-8産生抑制効果を示すことを見い出した。DDS誘導腸炎症モデルマウスによる実験でもクロロゲン酸の症状予防効果を確認した。
ただ、腸管上皮細胞のみのモデルは、腸管上皮細胞とその下層にある免疫細胞の相互作用までは再現できていない。「潰瘍性大腸炎では活性化したマクロファージが腸管上皮細胞を攻撃することが知られているため、両方の細胞を共培養することで生体モデルとして再現することにした」と薩氏。
こうした共培養は現在では当たり前の技術となっているが、当時は世界でも数例しか報告がなく、薩氏は先行例の論文を見ながら試行錯誤を重ね、腸管上皮モデルのCaco-2細胞と、活性化マクロファージのモデルであるヒトTHP-1細胞を2層に共培養した評価系を構築した。このモデルをそのまま放置すると、THP-1細胞が産生するTNF-αによって腸管上皮細胞に損傷が起きるが、抗TNF-α抗体などの阻害剤を投与すると損傷が抑制される。
同共培養モデルを用いて、腸管上皮細胞損傷を抑制する食品成分をスクリーニングした結果、カフェインとタウリンが腸管の損傷を抑制したという(図2)。薩氏は「カフェインはTNF-αの分泌量を抑制することで損傷を抑えることが分かった。タウリンはTNF-αの分泌量に変化がなかったため、そのメカニズムはまだ研究中である」と話している。
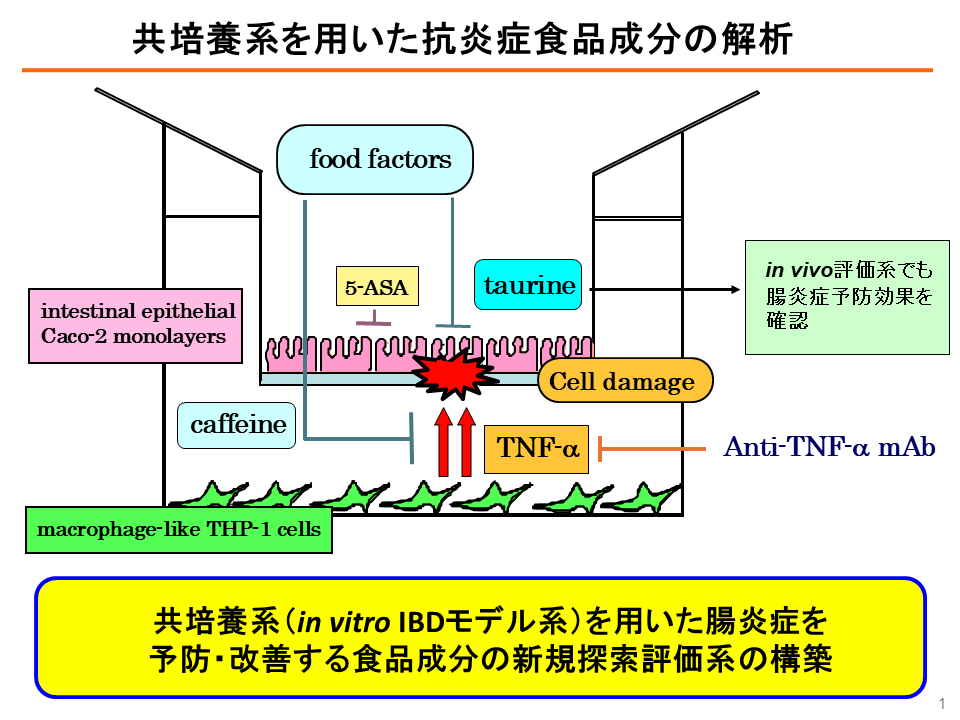
図2 腸管上皮細胞・マクロファージ細胞共培養による腸炎症モデルと食品成分の研究
他にも薩氏は腸管上皮細胞モデルを用いて、腸管の異物解毒・排出機能に関与する転写因子およびその応答を制御する食品成分、食品に混入する外来異物が腸管に及ぼす影響などの研究も進め、食の機能性、安全性に関する科学的エビデンス強化に貢献している。例えば、薩氏が腸管からの吸収経路や機能解析に関わったカルノシン(イミダゾールジペプチド)は、抗疲労と記憶力維持の機能性食品成分となっているが、薩氏と群馬県内の食肉企業との共同研究の結果、生鮮食品の豚肉では初めての機能性表示食品(疲労感軽減と記憶力維持)が誕生した。
薩氏は「私たちが機能性や安全性を検証した食品成分が商品化されたケースはいくつかある。それを継続するとともに、全く新しい機能性食品素材を世に出すことも実現したい」と今後の目標を語った。


