システム生物学は、生命現象をシステムとして理解する科学である。原子・分子から遺伝子・タンパク質、細胞、組織・器官、個体、集団・種・生態系に至るまで、階層化された生命の構成要素とその関係性を、AI(人工知能)などのコンピュータサイエンスや数学的な手法を用いて統合・解析し、システムとしての振る舞い、すなわち生物としての発現系や疾患の発症などにつながるプロセスを解き明かす。
このシステム生物学を用いて、難病のメカニズム解明や創薬標的探索を行う“人工知能創薬研究”を推進しているのが、国立研究開発法人医薬基盤・健康・栄養研究所 AI健康・医療研究センター上席研究員の伊藤眞里氏だ。
伊藤氏の研究生活は大阪大学でのがん免疫研究からスタートし、近畿大学で漢方医学、京都薬科大学で分子生物学、UCLAで放射線・遺伝学、大日本住友製薬で炎症疾患・自己免疫疾患・難治性呼吸器疾患の創薬研究、東京医科大学でiPS細胞を用いたリウマチの研究と、国内外の多くの研究機関、研究テーマに関わった。その末に、現AI健康・医薬研究センター長・水口賢司氏に出会って医薬基盤研に招聘され、システム生物学にたどり着いた。
「自分で意図したわけではないが、システム生物学に必要な幅広い生命科学の知識を身に付けることができた」と伊藤氏は振り返る。ちなみに、人工知能創薬研究のリーダーを務める水口氏は、数理モデルと構造生物学の専門家であり、伊藤氏と対照的なバックボーンを持つ研究者である。
伊藤氏は、大阪大学薬学部の3~4年生の頃から「人はなぜ病気になるのか、病気はどこから始まるのか」と自問するようになり、生化学の代謝マップを眺めて「病気は代謝経路のどこかに何らかの刺激が入ることで代謝物が変化して起きるのではないか、数学的手法を用いて解き明かすことができるのではないか」と考えるようになったという。
さらに、漢方医学を経験し、悪い臓器だけを見るのではなく、陰陽五行の要素でつながる全身を見て未病状態や予後を予測する手法を学んだが、「用いる手段は全く異なるが、人間をシステムとしてとらえ、予測する考え方はシステム生物学と同じだ」と指摘する。
特発性肺線維症の人工知能創薬研究
2017年から伊藤氏と水口氏が取り組んでいるのが、官民研究開発投資拡大プログラム『新薬創出を加速する人工知能の開発』で、難病の特発性肺線維症(IPF)を対象に創薬に特化したAIを開発し、それを活用して発症メカニズムの解明や創薬標的の探索を行っている。
「近年、多くの疾患で創薬標的の枯渇が指摘されているが、特に多様な因子が複雑に絡み合うIPFは、従来の手法では創薬標的が見い出せない状態であり、厚労省からAIを使って創薬標的を見つける研究を企画してほしいという依頼があってプロジェクトを開始した」と説明する伊藤氏。
さらに、「この研究ではマウスモデルや論文などに記載された疾患関連分子を標的候補とするのではなく、患者さんから得られた実臨床データを創薬に結び付ける“ベッドサイド創薬”の手法を導入したことが特徴」と説明し、「なぜなら、創薬過程で最大の障壁となっているPhaseⅡをクリアするには、ヒトで有効な標的を見つけて創薬することこそ重要であるからだ」と続ける。
実臨床データとは、電子カルテや臨床検査、画像などのデータである。実臨床データと30以上の遺伝子、タンパク質、代謝物、化合物、疾患などのデータベース、既存の文献情報などを、水口氏が開発したデータウエアハウス“TargetMine”を用いて統合・解析し、IPFの発症メカニズムの解明や創薬標的の発見を目指した(図1)。
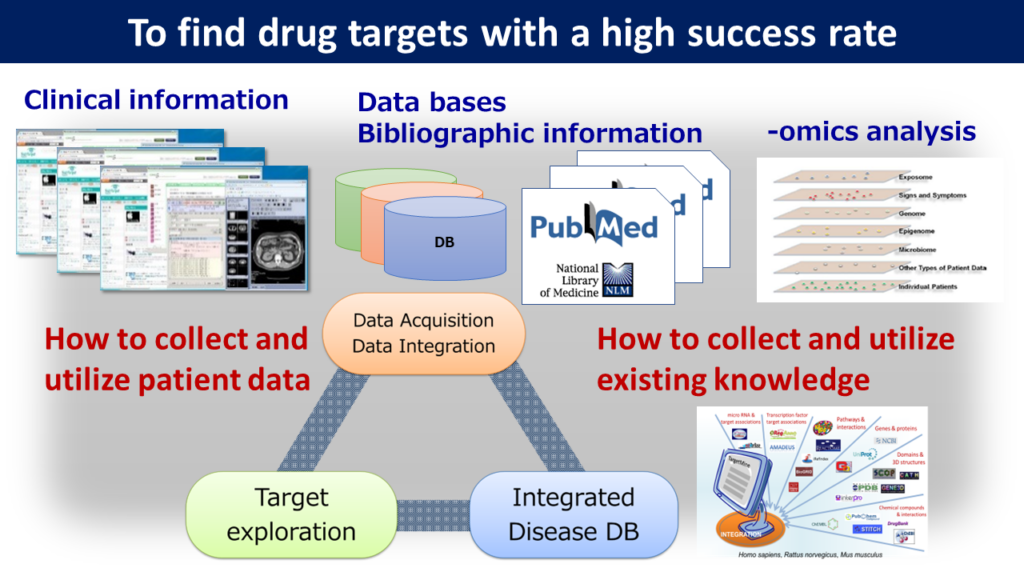
IPFを含めた呼吸器疾患患者の実臨床データを提供した大阪大学の他、京都大学、国立がん研究センター、産業技術総合研究所、理化学研究所など、管轄省庁の壁を越えて多数の研究機関がデータベースの提供やデータ解析などで協力した。
伊藤氏が人工知能創薬に実臨床データを用いたのには、もう一つの理由がある。「AIの開発や活用で日本は世界に後れを取っているとされるが、医療分野では他国にはない強みがある。医師が極めて丁寧に問診して詳細にカルテに記載していることと、国民皆保険であるために対象患者のほとんどで各種臨床検査データ、高精度な画像データがそろっていることだ」と、日本の最大の強みである高品質な実臨床データを活用する意義を強調する。
さらに、同プロジェクトの実臨床データには 伊藤氏が大阪大学と共同研究してきたエクソソームのデータが含まれていることが特徴である。エクソソームは細胞から分泌される小顆粒であり、血液中などに存在して細胞間の情報伝達を担う。
細胞間の情報伝達手段としては、細胞接着やサイトカインがよく知られているが、それらとの違いは離れた場所の細胞に情報伝達できることであり、病的な細胞から分泌されたエクソソームは、内部に各疾患に特徴的な分子を包含する。
伊藤氏らは、呼吸器疾患患者のエクソソームには健常者とは異なる成分が多数含まれ、中にはステロイドの感受性を示すようなバイオマーカーとして有用な成分もあることを論文発表している。
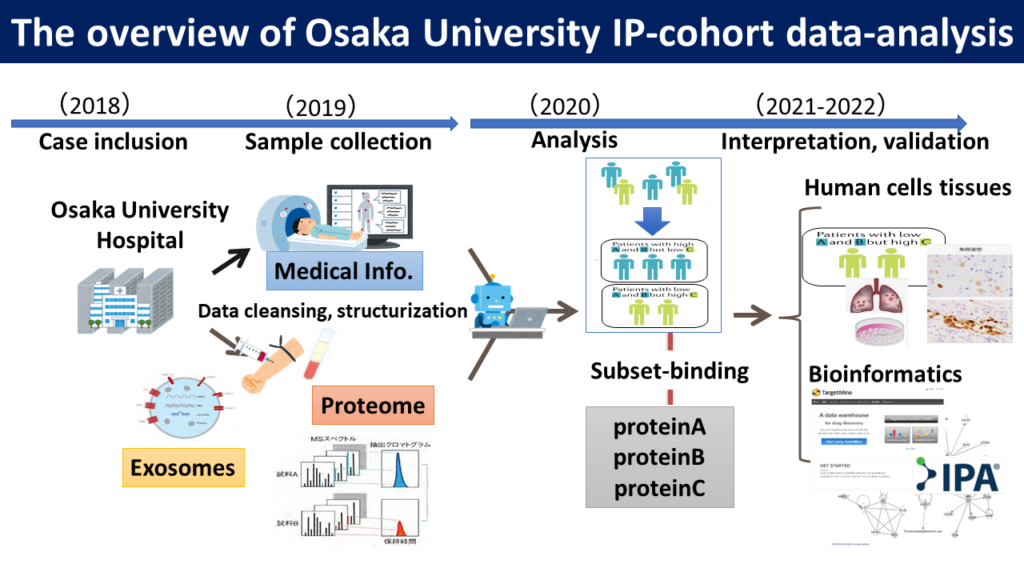
同プロジェクトでは、大阪大学医学部附属病院などから提供を受けたIPFを含めた間質性肺炎の患者の血液から分離したエクソソームに含まれる分子をオミックス解析し、他のデータと統合して疾患に特徴的なタンパク質を特定し、バイオマーカー開発や病態解明、個別化医療などにつなげようとしている(図2)。
研究や創薬の各プロセスでAIを活用する
人工知能創薬において、AIはどのような形で活用されているのか。一例を挙げると、日本語の文章で記載されたカルテの読影所見から、AIが必要な部分を自動的に抽出し、コンピュータが読み取れるように構造化し、データベースに取り込む。また、カルテ情報とエクソソームのオミックス情報を照合して、AIがIPF患者で発現するタンパク質を予測する。このような形で、研究の各段階で小規模なAIを開発して用いているという。
同プロジェクトでは、IPFを含めた562例の間質性肺炎患者、および健常者40例のデータなどのAI分析から、約20個のタンパク質が疾患関連分子の候補に挙がり、そのうち7個がIPFと強く関連するコアな疾患関連分子と推測された。
伊藤氏は、IPF患者の病変部位を用いたウエットな実験でそれらのタンパク質の発現を確認した。さらに、それらのタンパク質が生成されるパスウエイを作成し、パスウエイの上流で代謝を制御し、肺線維化を抑制できる可能性のあるタンパク質を見つけ出し、マウスやヒト細胞モデルによる実験や患者の血液や尿を使った実験でそれを確認したという。
伊藤氏は「このIPF関連コア分子は、体全体の代謝マップの中で糖代謝、脂質代謝に該当する部分にあることもわかってきた。次は原疾患や合併症との関係、個人ごとの違いを解明し、個別化医療につなげていきたい」と話している。
人工知能創薬は今、国内でもいくつかのプロジェクトが動き出している。伊藤氏は80以上の研究機関や企業・団体が参加するライフインテリジェンスコンソーシアム(代表=京都大学・奥野恭史氏)のプロジェクトにも参加し、創薬標的探索から臨床試験、市販後調査に至るまでの各プロセスで用いる約30種のAI開発に携わっている。
新たに同コンソーシアムの事業として、伊藤氏が代表となって各地域の健診データを集約・管理し、AIで可視化する基盤づくりもスタートした。
「これらが実現すれば、創薬の革新的なスピードアップや新しい健康ビジネスの創出につながるだろう」と伊藤氏は夢を語り、「若い研究者には『チャンスの神様は前にしか髪が無い』、つまり後からチャンスに気付いても掴めないので、迷わずに前に進もうとお伝えしたい」と結んだ。