感染症撲滅のための医療技術開発や創薬への応用に期待

岐阜大学大学院医学系研究科病原体制御学分野の永井宏樹教授、久堀智子准教授らのグループは3日、重篤な肺炎を引き起こす病原細菌レジオネラが宿主真核細胞のミトコンドリア機能を制御することを発見したことを明らかにした。
同制御は、細胞内に輸送されペアとなって働く2つのレジオネラ酵素がミトコンドリアADP/ATP 交換輸送体を可逆的に化学修飾するという機序に基づくことが示された。さらに、韓国科学技術院 (KAIST) Byung-Ha Oh 教授のグループとの共同研究により、脱修飾酵素の詳細な分子構造とその作用機構が示された。
同研究成果は、日本時間令和3日にProceedings of the National Academy of Science誌のオンライン版で発表された。
ミトコンドリアはヒトを含めた真核生物におけるエネルギー産生の中枢であり、感染においては病原体を排除するための主要な免疫応答を担う。これに対して、病原体の側は感染を果たすために様々なアプローチで宿主細胞のミトコンドリア機能を操作することが知られているが、その詳細な仕組みは明らかにされていない
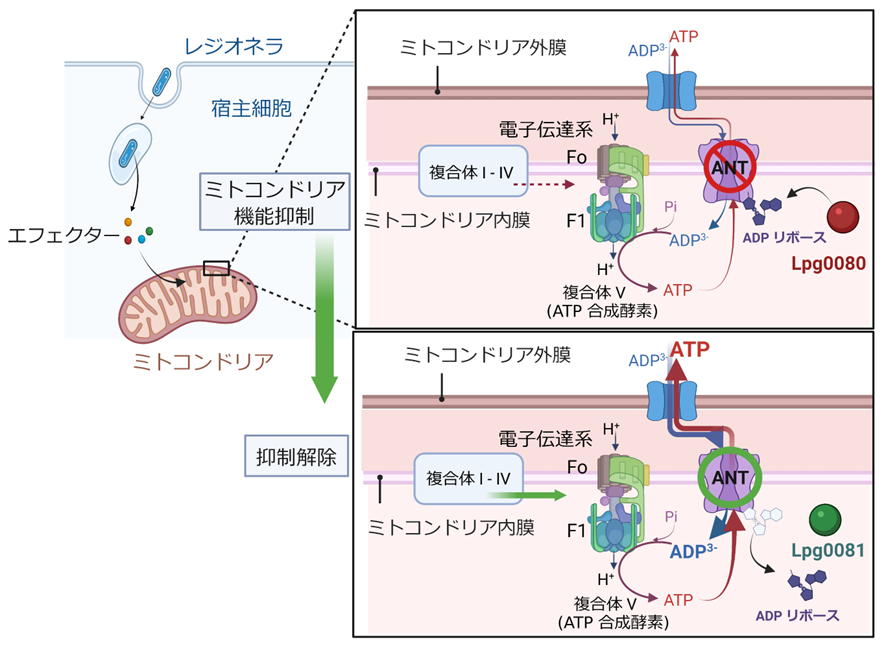
同研究では、重篤な肺炎を引き起こす病原細菌であるレジオネラがエフェクターと呼ばれる機能性タンパク質の持つ酵素活性を使ってミトコンドリア機能を制御することを見出した。レジオネラエフェクターのひとつであるLpg0080は、ミトコンドリア内外にADPやATP を輸送するポンプである ADP/ATP交換輸送体(ANT)に化学修飾を施すことで、それと連動して働くATP合成酵素を含めたミトコンドリア電子伝達系の作用にブレーキを掛けることがわかった。さらに、別のエフェクターであるLpg0081 は、ANTの化学修飾を外すことで、ブレーキを解除することも判明した。
ヒトをはじめとした真核生物の細胞には様々な細胞小器官があり、なかでもミトコンドリアは「細胞内に張り巡らされたエネルギープラント」として酸素を消費しATP を合成する役割を担う。ミトコンドリアの働きは細胞の営みに欠かせないが、その起源は実は細菌であったと考えられている。真核細胞の前身となる細胞に細菌が寄生し、共生進化を経て現在のような小器官として働くようになったとされている。
活発に増殖するがん細胞は「ワールブルグ効果」と呼ばれるミトコンドリアに依存しない代謝様式を持つことが知られているが、レジオネラなどの病原細菌が感染すると、正常な細胞も「ワールブルグ効果」様の代謝に移行することが近年報告されている。だが、その意味やメカニズムについてはまだほとんど解析されていない。
病原細菌は様々な酵素活性を持つタンパク質群を宿主細胞に輸送し、細胞システムを自らに有利に改変することで感染細胞の中で生存・増殖し、その結果として病原性を発揮する。これらの酵素群には細胞内分子に化学修飾を施すものが多くある。
その中で、ADPリボシル化活性は古くから多くの細菌毒素に見出されてきたが、細菌エフェクターの中にも ADPリボシル化酵素が徐々に見つかってきている。レジオネラは、病原細菌のなかでも極めて多彩なエフェクターを持つことで知られている。
レジオネラエフェクター間には、機能的なネットワークが存在し、細胞システムに対して巧妙かつ精緻な制御を実現している。
今回の研究成果の概要は、次の通り。
・レジオネラ遺伝子の配列を網羅的に解析することで ADPリボシル化酵素群を予測した。予測されたタンパク質のうち、Lpg0080 が実際にヒト培養細胞の標的タンパク質 ANTをADP リボシル化することを示した。
・Lpg0080によってADPリボシル化される ANT のアミノ酸残基の特定に成功した。その残基の立体構造上の位置から、この化学修飾がANTのADP/ATP交換輸送機能を阻害すると考えられた。
・別のレジオネラエフェクター Lpg0081が Lpg0080 によって ANT に付与されたADPリボースを取り除く活性を持つことを見出した。
・ミトコンドリアが産生する細胞内 ATPレベルはLpg0080の働きによって低下し、低下したATPレベルはLpg0081の作用によって回復することが示された。ミトコンドリア機能の指標となる細胞の酸素消費量を測定した結果、Lpg0080 存在下で低下し、Lpg0081存在下で上昇することが示された。
・Lpg0081とADPリボース複合体の結晶構造解析に成功し、Lpg0081 がマクロドメインという構造モジュールを持つADPリボシルヒドラーゼであることが明らかとなった。だが、Lpg0081はこれまで見出されているマクロドメインタンパク質には例のないユニークなトポロジーを持ち、収斂進化により獲得されたことがわかった。
同研究で示された可逆的なミトコンドリア機能制御が、実際に病原体感染においてどのような生物学的な意味を持つのか、つまり、「ミトコンドリア機能を回復させることが細菌にとってどのようなメリットがあるのか?」という重要な問いは今後の課題として残されている。
細菌が細胞の中で生き長らえるためには、長期的には細胞機能を正常に保つ必要があると考えられます。感染の経過や様々な細胞種、感染環境を含めた幅広い視点からの解析が今後必要になると考えている。
また、細胞質内に輸送された細菌タンパク質が、どのような仕組みで隔離された細胞小器官の内部(本研究の場合はミトコンドリア内膜)に到達し機能を発揮できるのかは、レジオネラのみならず様々な病原体による感染機構を分子レベルで理解する上での普遍的な問いに還元できると考える。感染に伴う様々な現象をそのメカニズムから解き明かしていく地道な基礎研究の蓄積が、最終的には感染症を撲滅するための医療技術の開発や創薬に繋がっていく。


