
(表面は角質化した表皮層、内部は線維芽細胞からなる真皮層など 6 層の構造を持つ)
理化学研究所(理研)とロート製薬は6日、皮膚に存在する細胞同士の「張力均衡」を生体外で再現した人工皮膚モデルを開発し、張力均衡が皮膚組織の構造と機能を制御していることを明らかにしたと発表した。理研生命機能科学研究センター器官誘導研究チームの辻孝チームリーダー、ロート製薬の木村駿研究員らの共同研究チームが解明したもの。
同研究成果は、皮膚の張力均衡の役割など皮膚科学研究に貢献するとともに、今回開発した人工皮膚モデルの利用により、皮膚の生理機能解析だけでなく、線維症や老化による皮膚のたるみや機能低下など、張力均衡が関与する疾患や老化の治療といった健康長寿に向けたヘルスケア領域の研究開発への貢献が期待される。
皮膚は、生体外から受ける圧迫などの物理的刺激に応答し、生体を保護する役割を持ち、その機能異 常と疾患の関連性が一部、明らかになっている。一方、「肌のハリ」として知られているように、皮膚内部では細胞同士が皮膚の面に対して平行な方向に引っ張り合う張力均衡と呼ばれる刺激も存在する。だが、張力均衡の役割については、生体外で研究モデルを構築する困難さから、これまで十分に解析されていなかった。
今回、共同研究チームは、生体の張力均衡を再現した人工皮膚モデルを開発し、張力均衡を生体外での人為的に操作により、張力均衡が皮膚の構造や機能に密接に関係していることを明らかにした。この張力均衡は、メカニカルストレスシグナル分子群を介して、表皮ターンオーバーや細胞外基質合成、機能性薬物への応答性機能に関与することを実証した。
同研究は、オンライン科学雑誌『Communications Biology』(10 月 30 日付)に掲載された。
外界や生体内におけるさまざまな物理的刺激が存在している。それらの物理的刺激は、メカニカルストレス(機械的ストレス)として発生や成長、老化、疾患に関与することが報告されており、現在の生物学・医学における重要な研究対象となっている。
皮膚は、外的な環境から体内を保護するバリア機能や物理的なクッションなど重要な役割を担っている。皮膚には、圧迫や引張など外部からの物理的刺激だけでなく、「肌のハリ」として知られているように、内部で細胞同士が皮膚の面に対して平行な方向に引っ張り合う状態が常に存在している。これは、真皮の線維芽細胞がコラーゲン線維を介して張力のバランスを取るもので、「張力均衡」と呼ばれている。そのため、生体から皮膚を切除すると収縮し(図 1)、収縮の方向性はコラーゲン線維やキメ、毛並みなどと一致する。
外傷や手術後の縫合など外部からの物理的な刺激による瘢痕(きずあと)形成に関する研究は進められている一方で、生体の張力均衡の分布は極めて複雑なことから研究が難しく、張力均衡の役割についてはよく分かっていない。
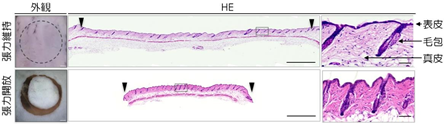
上段:切除される前の元の皮膚。中央列は皮膚断面の組織染色像で、右列は四角部分の拡大図。スケールバーは左列から順に 1 mm、1 mm、50μm(μm、1μm は 1000 分の 1mm)。
下段:円形に切り抜かれた皮膚。皮膚片は元の大きさよりも収縮することから、皮膚には常に張力のバランス「張力均衡」 が存在していることが分かる(左、中央列)。また、収縮によって天然皮膚の真皮の線維構造や毛包の配向性といった形態特徴が失われている様子が観察できる(右列)。
これまで皮膚の研究モデルとして、コラーゲンゲルと皮膚細胞で皮膚組織を再構築した人工皮膚「Bell 型モデル」が開発され、スキンケア製品の安全性評価を中心に利用されている。だが、疾患・老化研究や創薬研究応用を進める上では、より高度な天然皮膚の組織構造と機能性の再現が課題であった。
さらに近年、動物愛護の観点から、EU圏では香粧品の研究開発を対象にした動物実験が禁止され、一部の日本企業も自主的な動物実験廃止に向けた取り組みを進めている。そのため、安全かつ機能的なスキンケア製品の開発に向けて、動物実験代替法としてさまざまな生体外培養した人工皮膚が開発されているが、さらに天然皮膚の構造と機能を高度に再現した人工皮膚モデルの開発への期待が社会的に高まっている。
そこで共同研究チームは、天然皮膚の張力均衡を生体外で再現した人工皮膚を開発し、皮膚の組織構造と機能性制御に対する張力均衡の役割について検証した。
まず共同研究チームは、張力均衡の機能性を解析するために、張力均衡を再現した人工皮膚モデルの構築方法について検討した。天然皮膚を切除すると収縮することから、張力均衡は皮膚の形態に大きな影響を与える(図1)。
一方、従来の人工皮膚 Bell 型モデルでは、その構築過程で皮膚を収縮させることで張力が無くなるため、真皮のコラーゲン線維と細胞には配向性が認められない(図 2a 上段)。そこで、人工皮膚を培養容器で挟んで収縮を固定することで、張力均衡を再現した人工皮膚モデル「Tensional Homeostasis Skin model (THS モデル)」を開発した。
さらに、作製したTHS モデルを培養容器から切り離すことで張力を無くした人工皮膚モデル「Tension Release Skin model(TRS モデル)」を作製した。THS モデルは培養中収縮することがなく、組織構造は天然皮膚同様に張力と同じ水平方向にコラーゲン線維や細胞が整列している。
一方、この構造はTRS モデルでは失われ、Bell型モデルと同様の張力の無い構造に戻った(図 2a 中下段)。
また、THS モデルとTRS モデルの真皮線維芽細胞の立体形状を観察した結果、THS モデルの細胞は水平方向に一様に引き伸ばされている様子が観察された(図 2b)。以上の結果から、張力均衡の再現が皮膚組織の配向性の維持に重要であることが示された。
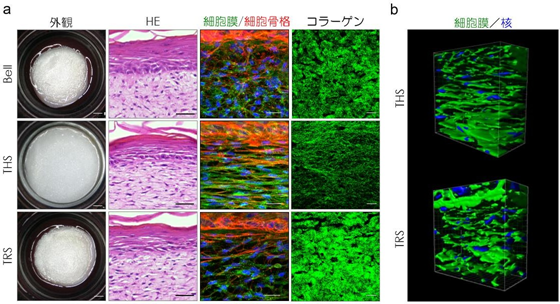
a) Bell 型モデル(上段)、THS モデル(中央)、TRS モデル(下段)の外観と組織構造を示す。THS モデルの外観は、人工皮膚を培養容器で挟んで固定した結果、細胞のけん引による収縮が起きておらず、張力均衡が再現されている(左列)。 HE 染色像は、全てのモデルにおいて正常な皮膚組織が形成されていることを示している(左から 2 列目)。一方、THS モデルの細胞膜、細胞骨格、コラーゲン線維は、張力均衡のない Bell 型、TRS モデルと比較して水平方向に引き伸ばされ、整列した構造となっていることが分かる(右側 2 列)。スケールバーは左列から順に、1 mm、50 μm、50 μ m、20μm。
b) THS モデルとTRS モデルの真皮線維芽細胞の 3D 構造。THS モデルの細胞は、水平方向に引き伸ばされ整列していることが分かる。
張力均衡の皮膚機能への作用を解析するために、人工皮膚を免疫組織学的解析で評価した結果、真皮の 1 型コラーゲン線維[6]量と表皮角化細胞[7]の増殖細胞比率の増加を確認した(図 3a)。さらに、抗光老化治療薬として知られる all-trans retinoic acid (ATRA)を投与したところ、THS モデルでは、Bell 型モデルおよびTRS モデルと比較して、ATRA による 1 型コラーゲンおよび ヒアルロン酸合成酵素の遺伝子発現が有意に増加していることが確認された(図 3b)。この結果から、張力均衡は人工皮膚の真皮形成と表皮ターンオーバーを促進し、皮膚の薬物応答性を活性化することが明らかになった。
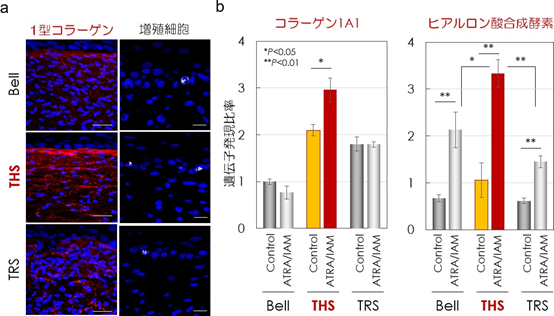
a) 蛍光免疫染色法によって、1 型コラーゲン繊維(赤)と表皮角化細胞のうち増殖中の細胞(白)を観察した。THS モデルでは、1 型コラーゲン繊維と表皮増殖細胞数が著しく増加していることが分かる。スケールバーは左列から 50 μm、20μm。
b) 抗光老化治療薬 ATRA によるコラーゲンの遺伝子発現促進作用は、THS モデルでのみ観察された。ヒアルロン酸合成酵素の遺伝子発現は全ての人工皮膚で促進されたものの、THS モデルで最も強く誘導された。
張力均衡の再現による皮膚機能活性化の分子メカニズムを解明するため、細胞のメカニカルストレス応答状態を解析しました。THS モデルでは、コラーゲン受容体である ITGA2、ITGA2 を介して細胞に伝達された張力を検知してコラーゲンやエラスチンの遺伝子発現を誘導する転写因子MRTF-A、MRTF-A により誘導される線維芽細胞の分化マーカーであるαSMA の三つのタンパク質量並びに細胞内局在の変化、そしてメカニカルストレスシグナルの活性化を確認した(図 4)。
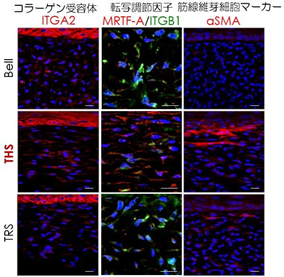
THS モデルではメカニカルストレスシグナル分子である ITGA2、MRTF-A、αSMA のタンパク質発現が増加し、特にコラーゲンやエラスチンの遺伝子発現を制御する MRTF-A が核内に移行し、遺伝子発現を活性化していることが分かる。スケールバーは全て 20μm。
これらの結果から、人工皮膚に再現された張力均衡の力は、コラーゲン線維とその受容体 ITGA2 による細胞接着構造を介して細胞内に伝達され、転写因子 MRTF-A の核内への移動を促して、コラーゲンやエラスチンといった細胞外基質の遺伝子発現を誘導し、皮膚機能を活性化していることが示された(図 5)。
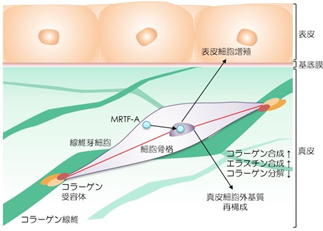
皮膚の張力均衡は、コラーゲン線維とその受容体ITGA2 を介して接着している線維芽細胞に伝達される。張力刺激を受けた細胞内の転写因子 MRTF-A は活性化し、核内へ移行することで遺伝子発現を開始し、その結果コラーゲン、エラスチンなどの真皮細胞外基質の合成促進、表皮角化細胞の増殖、薬物応答性の向上といった皮膚恒常性維持機能の変化を引き起 こすと考えられる。


