
昨今、ゾフルーザの耐性ウイルスが話題になっている。インフルエンザの耐性ウイルスは細菌の耐性菌とは違って、それがずっと居座るものではない。2001年、2002年に国内でタミフル、リレンザが治療に使われ出して、海外から「日本は、耐性ウイルスが蔓延するぞ」と心配されたが、当時、耐性ウイルスは見つからなかった。
ところが、2008-09年にソ連型と言われたH1N1のノイラミニダーゼのアミノ酸に変異が起こった耐性ウイルスが出現し、タミフルの感受性が低下した。
当時、日本で流行したインフルエンザウイルスの殆どがその変異を持っていたため、「これは大変だ」となったが、日本臨床内科医会インフルエンザ研究会では、唯一、臨床的にタミフルの効果が低下したかどうかの検討を行っている。
タミフルの感受性指標としてIC50 値がある。IC50 値は、薬剤がどのくらいの濃度でウイルス量を半分にできるかを計測するもので、値が低いほど薬剤が良く効き、高くなるほど効き目が悪い。
2008-09年は、タミフル耐性のH1N1型に対して、臨床医はそれを分からずにタミフルで治療していた。治療前のIC50 値は前年度の200倍になっていた。治療後もこの数値は変わらなかったため、タミフル治療によって新たな耐性ウイルスの出現は無かった。
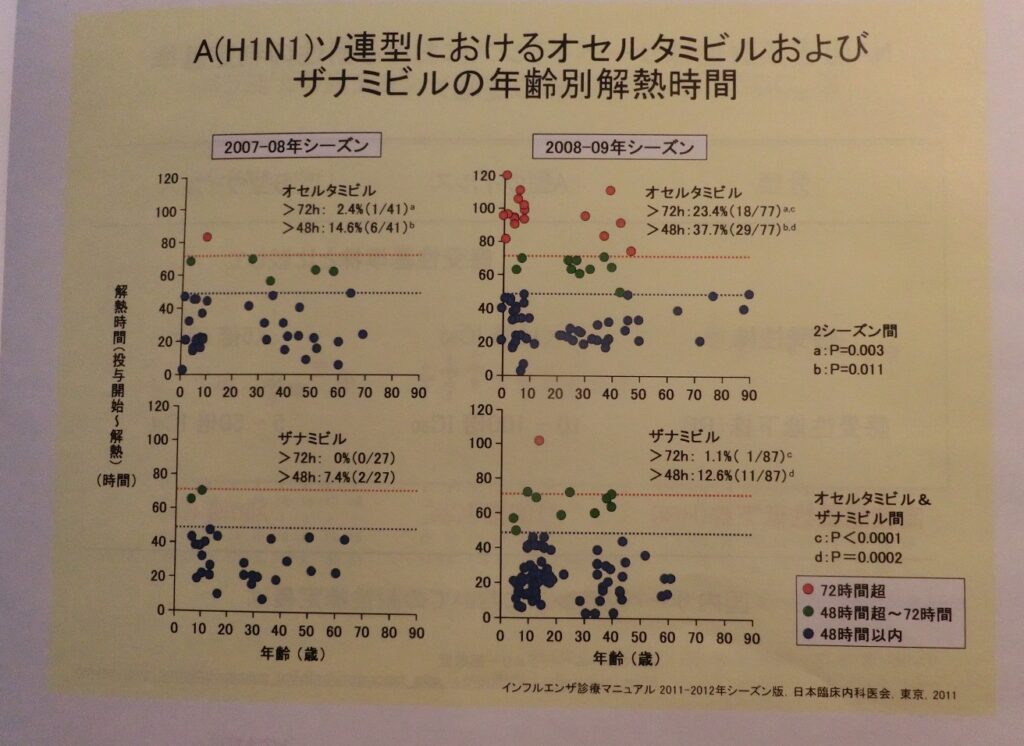
では、その時実際に臨床現場ではどの程度のインパクトがあったのか。Aソ連型について、タミフルとリレンザで治療した年齢別解熱時間を調べてみると、タミフルでは特に若年層で72時間以上解熱しない「効果がない」症例が見られた。ウイルスを排除する免疫力の弱い人では、薬の効果が少ない、あるいはないため解熱時間は大幅に増えてしまう。
だが、「タミフルで治療するともっと解熱時間が伸びて重症化する」症例は無く、「プラセボと同じか、薬剤量が足りないために効き目が悪い」ことが判明した。
タミフル耐性のH1N1型の治療についてまとめると、解熱時間は、リレンザでは影響はないが、タミフルは変異を持ったウイルスでは同年のH3N2(香港型)あるいは前年のH1N1(ソ連型)に比べて全体的に効果が悪い。だが、タミフル耐性の患者をタミフルで治療した場合、プラセボ群より悪くなることはなかった。
ノイラミニダーゼ阻害薬については、WHOがサーベイランスにおける耐性の判定基準を提唱している。それによると、感受性低下株は、A型ウイルスでは「IC50値が10倍以上100倍未満」、B型ウイルスでは「IC50 値が5倍以上50倍以下」と定義し、A型で「IC50 値100倍以上」、B型で「IC50 値50倍以上」上がった時を高度感受性低下株としている。
国内サーベランスにおける耐性株定義は、A型が「IC50値100倍以上、B型が「IC50値50倍以上」としている。この数値は、日本での我々の「IC50値が200倍になれば明らかに臨床効果が低下する」という報告を参考にしたものと考えられる。
その後、イナビルの感受性について市販後調査が実施され、我々は治療前の患者のIC50値の測定に協力した。市販後調査終了後もささやかながらこの測定を続けている。それは、「IC50値が上昇していないか」、「IC50値がひどく上がったウイルスが存在していないか」、「耐性ウイルスが居ない」かを確認するためである。
このような調査は、国立感染症研究所でも行っているが、我々も自分たちの症例の中に耐性ウイルスが存在するかを確認するために実施している。
タミフルの過去9シーズン(2010-11年~2018-19年)のウイルス型・亜型別IC50値を調べると、H3N2とB型では耐性ウイルスは存在しない。H1N1に関しては流行の度にIC50値が上がった症例がある。
これら症例について、解熱時間や肺炎発症率をみると、イナビルで治療されているものが殆どであったため問題はなかった。ラピアクタとタミフルは構造的に似ているため、ノイラミラーゼの変異は、ラピアクタの感受性にも影響することが判明している。
一方、H3N2(香港型)やB型は、なぜかノイラミニダーゼのアミノ酸部位に変異が起こらない。今、遺伝子を調べているが、生物学的に、何らかの強い制約がかかっているものと考えられる。
これらの知見から、タミフルとラピアクタに関しては、一定のある頻度で流行しているウイルスの中に、変異を持っているウイルスが居るものと考えられる。2008-9年時には、この変異株が全てになってしまったが、その後の9年間はパラパラ見られる程度で、タミフル耐性ウイルスがメジャーになることは今のところない。
リレンザに関しても、文献上は耐性ウイルスが世界で散発的に報告されているものの、我々の調査では日常的にそのようなウイルスに今のところ遭遇していない。
日本では、ここ数年、イナビルが非常にたくさん使用されてきた。同剤に関しても我々がインフルエンザの患者で採ったウイルスにおいて IC50値が上昇している例はない。
各薬剤の過去9シーズンのウイルス型・亜型別IC50値には異常が無い。従って、「これからも絶対に大丈夫」とは言えないものの、それほど心配しなくても良いと思われる。
“細菌の耐性”とは全く別の世界で、インフルエンザにおいては宿主の中でウイルスが1年流行しても、同じ変異を持ったウイルスがまた戻ってくるのかどうかは定かではない。夏にインフルエンザウイルスがどこに行っているのかも判っていないので、これらの解明は今後の課題となっている。
今、賑わっているゾフルーザの変異ウイルスにも言及したい。ゾフルーザの作用機序は、「キャップ依存性エンドヌクレアーゼ活性阻害」で、ポリメラーゼ産生タンパク質(PA)がその作用点のキーになっている。このPAにゾフルーザが結合してその活性を阻害する。
だが、ゾフルーザ治療群で、PAの38番目のアミノ酸であるイソロイシン(I)が、トレオニン(T)やメチオニン(M)、フェニルアラニン(F)に変異したI38変異ウイルスの出現が報告されており、注目されている。
ゾフルーザ投与患者におけるI38変異ウイルス検出度は、健康成人で9.7%(36/370)、12歳未満小児23.4%(18/77)、ハイリスク患者5.2%(15/290)で、これらは全て治療後の頻度である。治療前に耐性菌がみられるのと、治療後にみられるのとでは全く意味が違う。
タミフルで治療した小児では、「治療後、高率に耐性ウイルスが見られる」というデータが国内外で報告されている。だが、実際の臨床現場においては、この報告をそれほど気にせず、現在もタミフルを用いた小児への治療が行われている。
実際、我々の症例の中にも、成人でタミフル治療後に感受性ウイルスが分離されたという報告があるが、それが重症化したり、周りに広がったという実例はない。
ゾフルーザ耐性ウイルスについても、今後、治療前の流行の中でどのくらい広がるのか、それがゾフルーザによる治療に対してどれだけの影響が出るのか、注意深く見ていく必要がある。
ゾフルーザの臨床試験成績をみると、ウイルス量は、ゾフルーザ投与群の方がプラセボ群に比べて、1/1000、1/10000とすぐに減少する。
さらに、5日目以降にインフルエンザ症状が認められなかった患者の中で、ウイルスが残っている症例についてI38変異があったものと無かったものでは、変異があった方がウイルス力価は高かった。
だが、インフルエンザ症状が治癒した人の割合は、「変異あり」と「変異無し」では変わりなく、発熱が認められなかった患者の割合も同じであった。

実は、12歳未満の小児を対象としたI38変異有無別の症状及び発熱においても、6日目以降で見ると殆ど差はない。ただ、解熱時間ではなく罹病期間では、12歳以上の成人・青年対象においてI38変異無し51時間、変異あり63.1時間で少し長いように見えるものの、プラセボ群の80.2時間に比べると明らかに短い。とはいえ、このデータは年齢的な特徴が明らかにされていないため、この数字が統計的に有意であるかどうかの判定はできない。
また、12歳未満の小児を対象とした罹病期間は、I38変異なしが42.8時間、変異ありが79.6時間で、プラセボ群のデータはない。
我々は、こうした項目に、プラセボ群やタミフルなど他剤との比較データを加えなければ、I38変異株が出ることによる臨床的な意義の検討は難しいと感じている。
ゾフルーザでは、P3無作為化プラセボ対照予防投与試験も実施されている。この試験は、インフルエンザの人が出たら、家族にプラセボとゾフルーザを投与して、感染が防げたかどうかをみる試験で、私も専門家として関与している。
同試験の被験者背景は、第1発症者の感染ウイルス型/亜型は、H1N1、H3N2が半数ずつあって、第1発症者に対する治療薬も、ゾフルーザと他のインフルエンザ薬で半々に設定されている。
同居家族は、ゾフルーザ群374名、プラセボ群375名。ゾフルーザ投与群においてPCRでインフルエンザ陽性となった同居家族は63名で、そのうちI38変異が認められた同居家族は10名(2.7%)であった。
一方、プラセボ群は、インフルエンザ陽性が123名で、そのうち2名にI38変異が認められた。だが、プラセボ群でI38変異が認められた2例の同居家族は、3日目にインフルエンザを発症したため、そこでゾフルーザによる治療を受けていた。
この時、治療前のウイルスは野生型で、治療後のウイルスはI38変異型であったため、この2名は、I38変異型ウイルスが感染したのではなく、治療によってI38変異が誘導された症例であると考えられる。
従って、今のところ、I38変異ウイルスが、直接同居家族に感染した症例は見つかっていない。I38変異ウイルスは、感染能力が無いとは言えないが、普通のウイルスよりも優れていないと考えられる。
中国では、毎週のようにインフルエンザウイルスを採取し、症状のあった人と軽かった人のウイルスの力価をPCL法で比較した疫学的研究がある。
研究結果をみると、症状のあった人の方がウイルス量が多い。だが、ウイルス量が少なくても症状が結構重い人もいるため、ウイルス量が多いと良くないものの、ウイルス量とインフルエンザ症状の重症化は絶対的ではない。
ただ、ウイルス量を減らすことで症状は軽減できる。ウイルスを早く体内から減らすことができれば、重症化は防止できるので、24時間後にウイルス量を1/10000に減少させるゾフルーザに価値を見出すことはできるだろう。ウイルスを早く減らして、家族への感染を防止するという観点からも同剤を見ていく必要がある。
また、重症化したケースや、米国では発症後かなり時間が経ってから受診するケースが少なくなく、その中にもゾフルーザの有用性がある
インフルエンザの感染は、ウイルス1つでは起こらず、ある程度集団でヒトに感染した時にうつる。インフルエンザウイルスは、RNAウイルスであるため、一定の頻度でエラーが生じる。そのエラーは、複数の過程において、アミノ酸変異を有するウイルスが1万個に1個の割合で出現する。
増殖・発症の過程で野生ウイルスと変異ウイルスのヘテロな集団になると考えられている。ゾフルーザが投与されると、ワイルドタイプのウイルスの殆どが消えてしまうため、耐性ウイルスが出現しやすい状態になる。耐性ウイルスが、実際にインフルエンザ症状をどの程度長引かせ、症状を悪化させてヒトに感染していくのかを、我々は明確にしなければならないと考えている。
国立感染症研究所は、H1N1で1.5%、H3N2で9%の耐性ウイルスが検出されたと報告している。だがこの中には、ゾフルーザを投与された人、されていない人が色々と混じっており、臨床的予後がどうなったのかが明らかにされていない。
我々が今言えるのは、「H3N2において、ノイラミニダーゼ阻害薬では耐性ウイルスが見つからないのに、ゾフルーザではある一定の頻度で見つかっている」事実と、「それを調べて行けばこの割合がさらに高くなる可能性もある」ということである。
日本臨床内科医会でも、ゾフルーザ治療前と治療後の患者から採取したウイルスを調査している。その結果、N1H1では16例中治療後ウイルスは全く無く、N3N2では69例中8例ウイルスがみられ、8例のうち4例は変異ウイルスで、ほぼ治験と同じ成績であった。
耐性ウイルスが発生した4例の解熱時間は全て23時間で、耐性ウイルスが発生していない症例と変わりなかった。
たった4例では判定を下せないが、今のところ、耐性ウイルスが出たからと言って非常に予後が悪くなるエビデンスは出ていない。 あともう一つ注目すべきは、耐性ウイルスが取れた人の年齢が少し高かった点である。耐性ウイルスは、小児ばかりクローズアップされているが、小児以外でもある一定の頻度で出現する可能性がある。ゾフルーザの耐性ウイルスが社会にどのような影響を及ぼすかについて、これから十分調べていく必要がある。
今回の感染症学会の「小児への慎重投与への提言」については、「乱用してはいけない」という意味で、「小児に絶対使ってはいけないと制限するものではない」と解釈している。
小児への使用を全面制限するのではなく、変異ウイルスが治療にどの程度影響を及ぼすのかを注意深くみていきたい。
今年のタミフルの感受性を調べた成績では、治療前にN1H1では耐性ウイルスは無かったが、治療後には、成人で1例IC50 値が著しく上昇している症例がみられた。薬剤耐性ウイルスの出現に関しては、きちんとした疫学的研究をコンスタントに続けて行かねばならない。
我々臨床家にとっては、目の前のインフルエンザに罹患した患者に、どのような治療をしたら良いかを、もっと細かく判断できるデータの構築が非常に重要であることを改めて強調したい。


