京都薬科大学の石原慶一 准教授(病態生化学分野)らの研究グループは、始めてダウン症胎児における脳免疫細胞発生異常の可能性を発見したと発表した。
ダウン症モデルマウスから作製した胚性幹(ES)細胞や、ダウン症の方から作製した人工多能性幹(iPS)細胞を用いて、脳の免疫を担う脳マクロファージの前段階となる細胞「原始マクロファージ」の分化に障害がある可能性を初めて示したもの。
同研究グループは、これまでに脳の正常な発達に重要な役割を果たす脳マクロファージが、ダウン症モデルマウス胎仔の脳では少なくなっていることを発見していた。今回の研究では、数が減っているのは脳マクロファージの中でも「ミクログリア」と呼ばれる細胞で、さらにこの異常はより前の段階である「原始マクロファージ」の発生に問題があることを突き止めた。
この発見は、ダウン症における脳発達の遅れの仕組みを解き明かす新たな手がかりとなり、新しい治療法の考案において重要な知見となることが期待される。同研究成果は、国際的な科学雑誌 「Immunology」のオンライン版に、11月27日付で掲載された。
ダウン症は、通常2本ある21番染色体が3本になることで発症する染色体異常症で、ほとんどの方に知的障害が見られることが知られている。この知的障害の背景には、胎児期における脳の発達の遅れが関係していると考えられているがその詳しい仕組みはまだ解明されていない。
これまで研究チームは、ダウン症モデルマウス(Ts1Cjeマウス)の胎仔脳で、ダウン症胎児と同様に神経の発生が低下する、また一方では、脳の免疫細胞である脳マクロファージの数が減っていることを報告してきた。だが、なぜ脳マクロファージの数が少なくなるのかは不明であった。
そこで、幹細胞から「原始マクロファージ」を分化誘導する方法を用いてTs1CjeマウスのES細胞やダウン症の方から作製したiPS細胞から、脳マクロファージの前段階である「原始マクロファージ」へ分化させる実験を行った。
脳マクロファージは、代表的な脳の免疫細胞である「ミクログリア」のほか、髄膜マクロファージや血管周囲マクロファージといった脳の境界に存在するマクロファージも含んでいる。
研究グループはこれまで、Ts1Cjeマウスの胎仔脳で、脳マクロファージの数が通常のマウスより少ないことを発見していたが、どの種類の細胞が減っているかは不明であった。
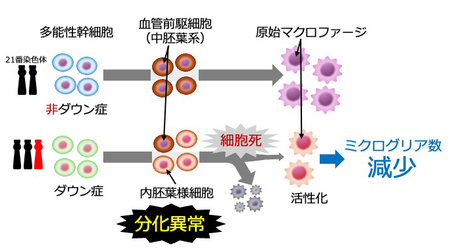
今回の研究では、Ts1Cjeマウスの胎仔脳を詳細に調べた結果、脳マクロファージの中のミクログリアが減少していることが分かった。そこで、ミクログリアの前段階である「原始マクロファージ」への分化異常について、Ts1CjeマウスからES細胞を樹立し、原始マクロファージへの分化過程を調べた。
その結果、正常マウス由来のES細胞に比べてTs1Cjeマウス由来のES細胞から分化した原始マクロファージは、その数が非常に少ないことが判明した。さらに、網羅的な遺伝子発現解析により、Ts1Cjeマウス由来ES細胞は、本来中胚葉系に分化する条件下にもかかわらず、内胚葉系の特徴を持つ細胞に分化し、その後多くが死滅していることが分かった。
また、少ないながらも分化誘導で得られたTs1CjeマウスES細胞由来の原始マクロファージの遺伝子発現解析では、通常のマウスから得たES細胞から分化した原始マクロファージとは異なり、マクロファージが「活性化」したときの遺伝子発現パターンを示すことを見いだした。
一方、Ts1Cjeマウスの胎仔組織でもミクログリアや原始マクロファージの数が減っていることも確認できた。さらに、Ts1Cjeマウス由来ES細胞の分化実験で認められた異常は、ダウン症の方から樹立したiPS細胞でも再現されたことから、モデルマウスのみならずダウン症の方でも認められると推察される。
今回の研究で、ダウン症において「原始マクロファージ」の発生に異常がある可能性を初めて示された。この異常は、脳の発達が遅れる原因の一つになっていると考えられる。
今後は、ダウン症の胎児における原始マクロファージやミクログリアの異常に注目した研究を進めるとともに、詳しい分子レベルの仕組みを解明し、原始マクロファージやミクログリアを標的とした新しい治療法の開発につながることが期待される。


