
血液脳関門は、今も脳疾患治療薬などを開発する上で分厚い壁となっている。東京薬科大学薬学部の降幡知巳教授(医療薬学科個別化薬物治療学教室)は、オリジナルのヒト不死化細胞を使って、ミクロサイズの血液脳関門の生体模倣システムの開発に成功し、国内外の研究機関や製薬企業から大きな注目を浴びている。
生体外で幹細胞などから3次元的に培養した臓器モデルは、通常、“オルガノイド”と呼ばれるが、降幡教授が作成したヒトの脳モデルはオルガノイドとは少し異なるものだという。
「オルガノイドは、細胞が分化して臓器や組織を形成する過程を再現し、各種細胞の配置も本物の臓器に近いものだが、生体に近すぎるがゆえに、ある種の実験には適していないこともある。われわれの脳モデルは、生体模倣システムの一種であるが、複数の細胞を用途に応じて人工的に配置した階層型のスフェロイドである」。
血液脳関門は、その本質的な機能、すなわち血液から脳への物質移行を制限する機能にはヒトと動物で違いはないが、その機能実体を担うタンパク質の分子レベルには種差があり、この差があるがために、動物実験で成功したとしても臨床試験では成功しないことがある。そのため、ヒト細胞を用いた実験が必要となる。降幡教授によると、1990年代からヒトの細胞を使った血液脳関門モデルの研究が散見されるようになるが、ヒト細胞が手に入りにくいことからその進展は遅く、さらに血液脳関門モデルを用いてどのようにヒト生体の薬物脳移行性を予測評価するかといった方法論にも大きな進展が見られない状態が続いていたという。血液脳関門の研究では後発組である降幡教授はここに着目し、ヒト細胞を用いた独自の血液脳関門モデル開発を目指すようになった。
降幡研究室のホームページで、ヒト血液脳関門モデルの開発プロジェクトは「死なない細胞で、いいかげんにヒト脳を創る」と紹介されている。キーワードのひとつは、死なない細胞、すなわち不死化細胞である。血液脳関門を構成する主な細胞は、脳毛細血管内皮細胞、その周囲を取り巻く血管壁の細胞であるペリサイト、脳細胞の一つであるアストロサイトの3種類である。降幡教授は、「これまで血液脳関門の実験で用いられてきたヒトの細胞は、死後脳や手術時摘出試料などから採取して培養した初代培養細胞だが、1~2週間で実験には不適となるため、3種の細胞を数十万円かけて購入しても、1回の実験で使い切ってしまう。多くの研究者が自由に研究できるヒト血液脳関門モデルを構築するためには、無限に細胞分裂する能力を獲得した不死化細胞(細胞株)の樹立が必要だと考えた」と説明する。
そこで、降幡教授はまず、ヒトの脳毛細血管内皮細胞の初代培養細胞に不死化遺伝子を導入し、独自に不死化細胞を樹立。次いで、ヒトペリサイト、ヒトアストロサイトでも不死化細胞を樹立した。数十~百種ほどの細胞クローンの中から質の良い細胞を絞り込んでバリデーションも実施し、その素材や作成方法、機能などもすべて論文で公開した。
さらに、これらの不死化細胞に可逆性を持たせたことも大きな特徴だ。
「一般に、分裂増殖中の細胞と成熟して分裂を止めた細胞の機能は異なり、増殖しているうちは本来の細胞の機能を発揮できない。そこで、われわれが樹立した3つの細胞は、温度によって、この2つの状態を使い分けられるようにしている」。
降幡教授らが開発した技術ではないが、温度依存性SV40遺伝子という技術を用いたことにより、3種の細胞は33℃で不死化状態となって増殖する一方、ヒトの体温に近づくと増殖を止め、薬物輸送に関与するトランスポーターやトランスサイトーシス受容体などが本来の機能を十分に発揮する。つまり、温度によって、血液脳関門が働いている状態、働いていない状態の2つの実験環境を創り出せるという。
もうひとつのキーワードは「いいかげん(加減)」。ある本で使われていた表現を応用したものだという。つまり、ちょうど良い程度にという意味で「臓器を模倣するものではあるが、オルガノイドのように全体を緻密に本物に近づけるわけではない」と降幡教授は指摘する。例えば、脳オルガノイドでは、脳組織の中に直径数十μmの毛細血管が埋め込まれているようなものが多いが、薬物動態の実験に用いる場合、このような極めて細い血管を介して薬物の脳移行を調べることは極めて難しい。また、血液脳関門の薬物透過性実験に用いる場合は、血管側と脳実質側を明確に判別できる構造が好ましい。どこまで本物の臓器を模倣し、どこまで実験のニーズを反映するのか。「その交点を探ることが、『いいかげん(加減)』という言葉の真意だ」と降幡教授。
構造的な特徴は、本来の血液脳関門の構造をあえて反転させたことだ。ヒトの脳では、管腔構造を持つ毛細血管をペリサイトが覆うように取り囲み、その外側にアストロサイトがある。降幡教授らの血液脳関門モデルは、逆に一番内側がアストロサイトで、その外側を丸く囲む形でペリサイト、さらに外側に脳毛細血管内皮細胞の順で配置されている。脳毛細血管内皮細胞の外側が血液で、内側が脳実質という構造だ(図1)。そのため、外側(血管側)に薬物を添加し、それが内側(脳側)に移行するかどうかを見れば、その血液脳関門透過性を判断できる。
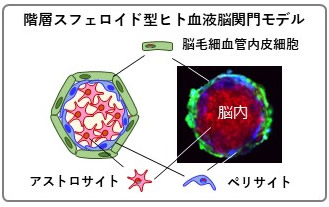
また、3D培養したことにより、2D培養した場合に比べて、血液脳関門のバリア機能に関連する細胞間接着因子、薬物輸送に関与するトランスポーター、トランスサイトーシス受容体などのタンパク質が、血管側に高く発現することが確かめられた。これらのことから、降幡教授は「人工的に創ったものだが、生体の血液脳関門に非常に近い機能を有しているといえる」と期待を示す。
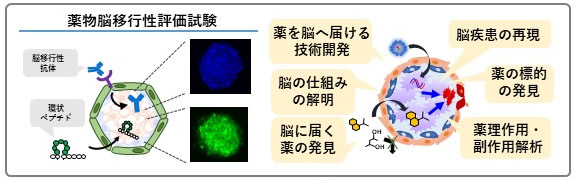
前述のヒト血液脳関門モデルは、エーザイ、小野薬品工業と連携して開発してきた。すでに降幡教授らは、このヒト血液脳関門モデルを使って薬物の脳内移行評価実験を行っている。例えば、高分子の細胞内輸送に関わる代表的なトランスサイトーシス受容体であるトランスフェリン受容体(TfR)をターゲットにした薬物の脳内移行を評価する実験。いくつかの抗TfR抗体を蛍光標識してヒト血液脳関門モデルで検証すると、各抗体の脳内移行性の違いが明らかになったという。
「製薬企業にとって、抗体、核酸、ペプチドなどの高分子医薬品を、いかにして脳内に届けるかが大きな創薬課題である。TfR以外にも多くの標的があることが分かっている」と降幡教授は指摘し、脳疾患治療薬開発における薬物動態研究での活用に期待を寄せる。
また、もうひとつの応用分野として取り組んでいるのが、脳疾患の再現だ。例えば、多発性硬化症や脳梗塞などの脳疾患で見られる脳毛細血管から脳組織への免疫細胞の浸潤を、脳スフェロイドモデルで再現することである。これまでの予備的な実験で、炎症性物質がある環境下では脳毛細血管細胞上に免疫細胞をトラップする分子が発現し、免疫細胞が多く集まる状態になることが示されたという。今後は、免疫細胞が血液脳関門を越えて脳内に浸潤するメカニズムの解明とそれを制御する薬剤の研究、現在の血液脳関門モデルに神経細胞を加えた、より脳に近いモデルの開発などに力を注ぐ予定だ。これら一連の「血液脳関門に注目した新たな創薬研究」を通じ、血液脳関門を標的とした新たな創薬領域「血液脳関門創薬」の確立を思い描く。一方で、脳血管モデルで培った技術を他臓器へも応用し、生体模倣多臓器システムの開発にも意欲を示す。
最後に降幡教授は「新たなモデルを創ることや一流誌に論文が掲載されることが本研究のゴールではなく、われわれのモデルを使ったからこそ新しい薬が生み出され、それが患者さんもとに届くことがゴール」と強調するとともに、若い研究者に向けて、「リスクを考えずにまず試みること、常に自分の研究と他者の研究との未来の交点を探し続けることが大切」とメッセージを送った。


