自然発症の歩行異常ラットと出会い、発症原因を探る

大阪公立大学大学院准教授の田中美有氏(獣医学研究科獣医病理学)は、神経変性疾患の一つである神経軸索ジストロフィー(Neuroaxonal dystrophy; NAD)のモデルラットを確立し、その病態メカニズムを解明した。
田中氏は動物の細胞や組織を顕微鏡で観察して病気を診断する獣医病理医として病理検査にも携わりながら、研究を続けてきた。メイン研究テーマは、「モデル動物を用いたヒト疾患の病態メカニズム解明」および「動物の自然発生病変の病理学的解析」であり、後者では伴侶動物、動物園・水族館動物、家畜、実験動物などあらゆる種類の動物を対象とする。病変も腫瘍、感染症、遺伝性疾患など多種多様であり、それらを基に田中氏は病理診断、死因検索、様々な疾患の病態メカニズム解明などを行ってきた。
田中氏は「病理学的研究を行う際には、常に動物の種差を念頭に置きながら、研究を行ってきた」と話す。中でも、動物の神経疾患が田中氏の専門分野である。NADは、神経細胞の軸索の一部が腫大することにより神経信号の伝達が障害され、運動や感覚に異常をきたす神経疾患群である。NADに分類されるヒトの代表的疾患には、遺伝性の乳児型NADなど小児慢性特定疾病も含まれ、治療法確立を目指した病態解明が課題となっている希少疾患である。
NADは動物でも発生し、イヌ、ネコ、ウシ、ウマ、ヒツジ、ハトなどで症例報告がある。田中氏とNADの動物との最初の出会いは、獣医学部の学生時代に経験した自然発症NADのパピヨンの子犬の症例だった。このパピヨンには企図振戦、四肢伸展、起立不能などの神経症状があり、死後の病理検査で中枢神経系における軸索腫大(スフェロイド)と軽度の小脳萎縮が認められ、NADと診断した。のちに東京大学との共同研究によって、ヒトの乳児型NADの原因遺伝子と同一の PLA2G6 (phospholipase A2 group VI)遺伝子の変異が同定された。
次に田中氏が遭遇したのが、獣医学部卒業のタイミングで京都大学医学研究科附属動物実験施設から託された歩行異常ラット(通称:KKラット)であり、これがNADモデルラット確立に至る研究の発端となった。このラットは、ミュータジェネシス法によるてんかんモデル作製の過程で偶然出現した歩行異常ラットから、てんかんの原因遺伝子変異を除いて系統化したものである。つまり、てんかん以外の原因で歩行障害を自然発症したと考えられた。
田中氏がKKラットの症状を詳しく観察すると、発症ラットは3~4週齢から体格が小さく(低体重)、6~7週齢で明らかな後肢の歩行異常が出現し、歩行異常・削痩の進行を経て、10~11週齢という若齢で死亡した。中枢神経系(脳・脊髄)の病理組織学的検査を行ったところ、2~3週齢から脊髄においてスフェロイド(腫大病変)が認められ、病変は背索(背中側の白質)でより顕著であった(図1)。また、週齢が進むにつれてスフェロイドは大型化し、数も増加した。脳では延髄や小脳を中心にスフェロイドが認められた。
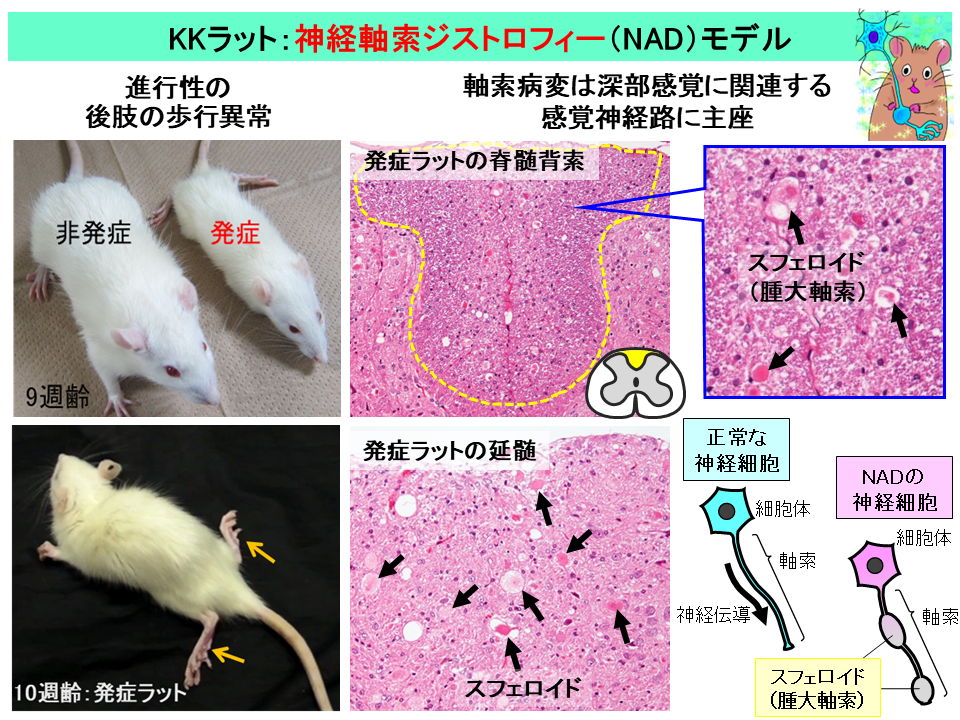
これを見た田中氏は「過去に遭遇したパピヨンの症例と同じく、KKラットの神経病変はNADである」と結論するとともに、さらに詳細な神経病理学的解析を進めた。その結果、スフェロイドは脊髄全域に認められるが、胸髄、腰髄、仙髄の背索(特に薄束:下半身からの感覚情報を伝える神経路の一部)でより顕著であること、延髄や小脳におけるスフェロイドの詳細な局在を明らかにした。
また、スフェロイドの免疫組織化学的解析では、シナプス関連蛋白、ニューロフィラメント、ユビキチンなどの蓄積が、電子顕微鏡観察では変性ミトコンドリア、異常な膜状・管状構造などの蓄積が認められた。以上から、KKラットは、深部感覚に関連する感覚神経路に主座する軸索病変によって感覚性運動失調を呈していると考え、軸索輸送の異常およびシナプス機能異常の関与を疑った。
原因遺伝子を同定し、NSDモデルラットを確立
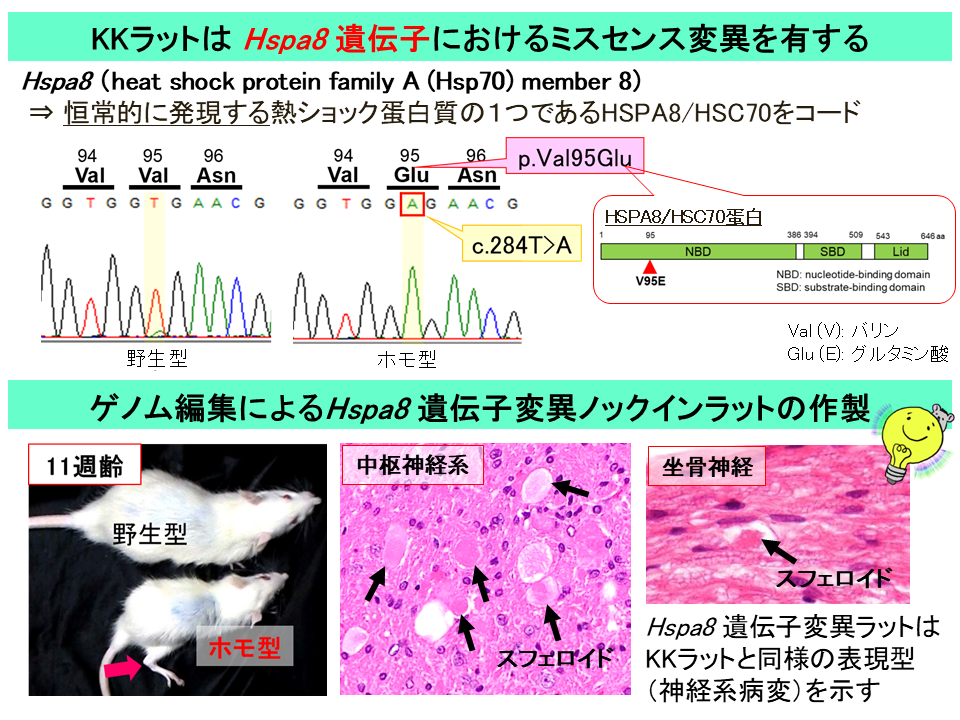
さらに田中氏は、共同研究でKKラットの原因遺伝子同定に挑戦した。遺伝子解析の結果、細胞を保護する蛋白質群として知られる熱ショック蛋白HSPA8/HSC70をコードするHspa8(heat shock protein family A (Hsp70) member 8)遺伝子にミスセンス変異(アミノ酸一つが別の種類に変わる変異)を発見した。田中氏らは、ゲノム編集技術により、KKラットで同定したHspa8遺伝子ミスセンス変異を正常ラットに導入したノックインラットを作製。このラットの病変解析によって、Hspa8遺伝子変異ラットが、自然発症のKKラットと全く同じ感覚性運動失調や神経軸索の腫大などの表現型を示すことを確認した(図2)。
「HSPA8/HSC70は熱ショック蛋白ファミリーに属するが、全身で常時発現している重要な蛋白だ。そのため、たった一つのアミノ酸が置き換わっただけの変異でも神経系で重篤な障害を引き起こすと考えられる」と田中氏。研究開始から10年以上が経過していたが、田中氏はこれら一連の研究でKKラットのNADの発症原因がHspa8遺伝子変異にあること、KKラットがNAD疾患モデルとして有用であることを論文発表。2023年9月には ケー・エー・シー創立45 周年記念研究助成に採択された。
図
続いて取り組んでいるのが、NAD疾患モデルとしてのHspa8遺伝子変異ラットを用いた、NAD発症に至るメカニズムの解明である。Hspa8遺伝子がコードするHSPA8/HSC70蛋白の機能としては、①シャペロン介在性オートファジー(CMA)という特殊なオートファジーへの関与、②軸索内の速い輸送と遅い輸送のスイッチとしての役割が知られていた。
田中氏は「シャペロン介在性オートファジーは、蛋白質を選択的に分解することができることが特徴だが、メカニズムや疾患との関連は不明な点が多い。私たちは、同定したHspa8遺伝子変異によってCMAの機能異常(低下)が起こると考えている」と述べる。同様に軸索輸送についても「Hspa8遺伝子変異によって軸索輸送障害が生じる」として、「CMAと軸索輸送の両方の破綻が重なり、NADとばれる病態に陥ると考えられる」と続ける。
HSPA8/HSC70蛋白の発現異常やCMAの活性異常と、ALSやパーキンソン病との関連を示唆した報告もあるが、Hspa8遺伝子変異がヒトや動物の神経変性疾患の直接の発症原因とする報告は田中氏らが初めてであり、今回確立した疾患モデルラットを用いた研究の進展が期待される。
田中氏は「近年はゲノム編集技術の進歩により、ヒト疾患関連遺伝子をノックアウト・ノックインして動物で病気(表現型)を再現し、病態解明を行う逆遺伝学的なアプローチが主流となっている」と明言する。
さらに、「一方、変異動物の表現型の丁寧な解析から出発して原因遺伝子の同定にいたる順遺伝学的アプローチはやや下火になりつつある。しかし、同じ遺伝子変異でも動物種によって表現型が異なることは少なくなく、種差を考慮した研究視点も重要である。私自身の研究でも、順遺伝学的手法から思いがけない発見や新たな研究の芽が得られてきた。その面白さと可能性を、次世代の若い研究者にもぜひ伝えていきたい」と抱負を述べる。


