多能性人工細胞設計に重要な指針を与える研究成果として期待
岐阜大学高等研究院の東小百合特任助教は、ドイツ・ミュンスター大学のSeraphine V. Wegner教授らとの共同研究により、巨大リポソーム内の金属酵素の活性を制御する技術を確立し、外部からの刺激 (金属イオン) に応じて異なる運命を辿る人工細胞の開発に成功した。
同研究成果は、細胞分化を模倣した「多能性人工細胞」の設計に重要な指針を与えることが期待される。多能性幹細胞とは、自己複製しながら、複数の異なる細胞系統(神経細胞、筋細胞、血球など)に分化できる能力を持つ細胞である。
発生初期において体のさまざまな組織や臓器を形成する細胞源として重要だ。細胞の初期状態である多能性幹細胞は、遺伝子発現の調整や転写因子のフィードバックループの形成、成長因子やホルモンなどの外部シグナルの入力などの制御機構により、潜在的に持つ多様な機能の中から特定の機能を発現すると同時に他の機能の発現が抑制されることで最終的な分化が成立する。
近年、細胞現象の理解およびバイオ材料への応用を目指し、人工的に細胞を創る試みが活発に行われている。これまでは、多くの中から1つの細胞現象に絞って再構築する研究が進展してきた。
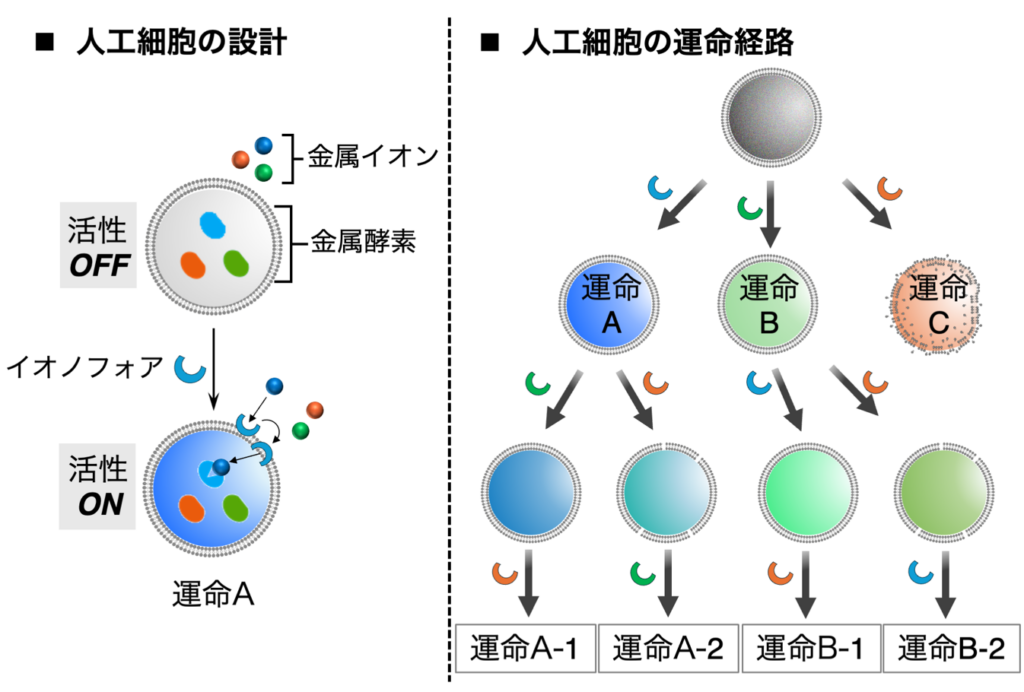
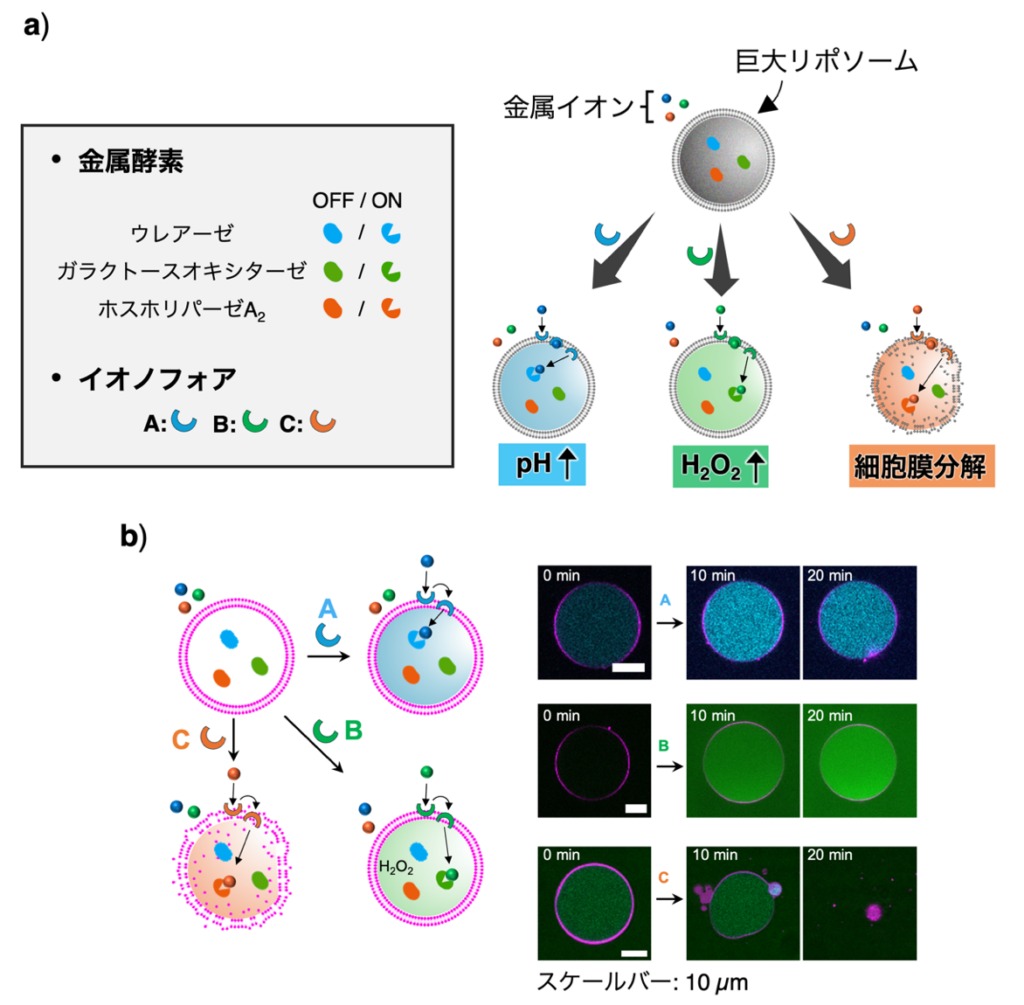
一方、今後の課題は、多くの細胞現象を1つの人工細胞で再現することにある。東氏らの細胞は、細胞膜上にトランスポーターやチャネル、受容体など様々な膜タンパク質を持ち、周囲の変化に応じた機能を発揮する。同研究では、細胞サイズの巨大リポソーム膜に特定の金属イオンを透過させるイオノフォアを結合し、輸送された金属イオンによって異なる機能を示す人工細胞を開発。互いに機能の異なる3種類の金属(依存性)酵素を巨大リポソームに同時に内包することで人工細胞を作製し、イオノフォアによる金属イオン輸送で金属酵素の活性の制御に初めて成功した。
さらには、最初に活性化された金属酵素が人工細胞の運命を決定し、他の経路の活性化を抑制する仕組みも実証した。同研究成果は、昨年12月23日にNature Chemistry誌のオンライン版で発表された。
近年、人工細胞の開発が活発に行われています。具体的には、細胞の構成因子を用いた構造や機能の模倣により、細胞現象の理解や自律的に動くバイオ材料への応用を目指した取り組みが進められている。細胞の持つ機能を模倣する研究として、遺伝子発現(複製・転写・翻訳)、 ATP(アデノシン三リン酸)生成、複数の酵素反応からなる代謝、細胞分裂や融合、細胞同士の接着や情報伝達といった重要かつ基礎的な機能を示す人工細胞の開発が進められてきた。だが、既存の人工細胞の多くは、これらの機能のうち1つの機能に焦点を当て、外部刺激に応答してその機能が発現するよう設計されている。一方で、実際の細胞はこれらの機能を全て備え、細胞内外の環境の変化を刺激として認識・応答して特定の機能を示す高度な適応性を持っています。このように周囲の環境に応じて異なる機能を示す人工細胞の開発は世界的にも先行例が殆どない。
東氏は、ドイツ・ミュンスター大学のWegner教授らとともに、巨大リポソーム (Giant unilamellar vesicles, GUV)注1 を人工細胞膜として使用し、リポソーム内部への生体分子の封入および人工細胞膜を工夫し、新しい機能を持つ人工細胞の開発に取り組んでいる。同研究では、細胞の適応性を人工細胞で模倣し、3種類の異なる刺激に応じた機能を示す人工細胞の開発を目指した。人工細胞での適応性の実現には、外部刺激を内部に正しく届ける仕組みが重要である。細胞では、細胞膜上に発現しているトランスポーターやチャネル、受容体といった膜タンパク質が、細胞膜を通過できない物質を輸送または結合することで多様な反応 (細胞現象) が起こる。
同研究はこの仕組みに着想を得て、特定の刺激を内部に届けるトランスポーターを人工細胞膜に結合させた。具体的には、巨大リポソーム内に互いに異なる機能を示す3種類の金属(依存性)酵素 を内包することで人工細胞として扱った。各金属酵素の活性は細胞膜に結合させたイオノフォア による金属イオン輸送で制御が可能である。この設計により、人工細胞外部の特定の金属イオンがイオノフォアを介して細胞内に輸送され、対応する金属酵素のみが活性化して機能を発揮することが期待された。実際、人工細胞外部に3種類の金属イオンを共存させた環境で特定のイオノフォアを細胞膜に結合させると、イオノフォアの選択に応じて異なる機能を示すことが証明された (図1)。これにより、実際の細胞に近い適応性を人工細胞に付与することができたと言える。
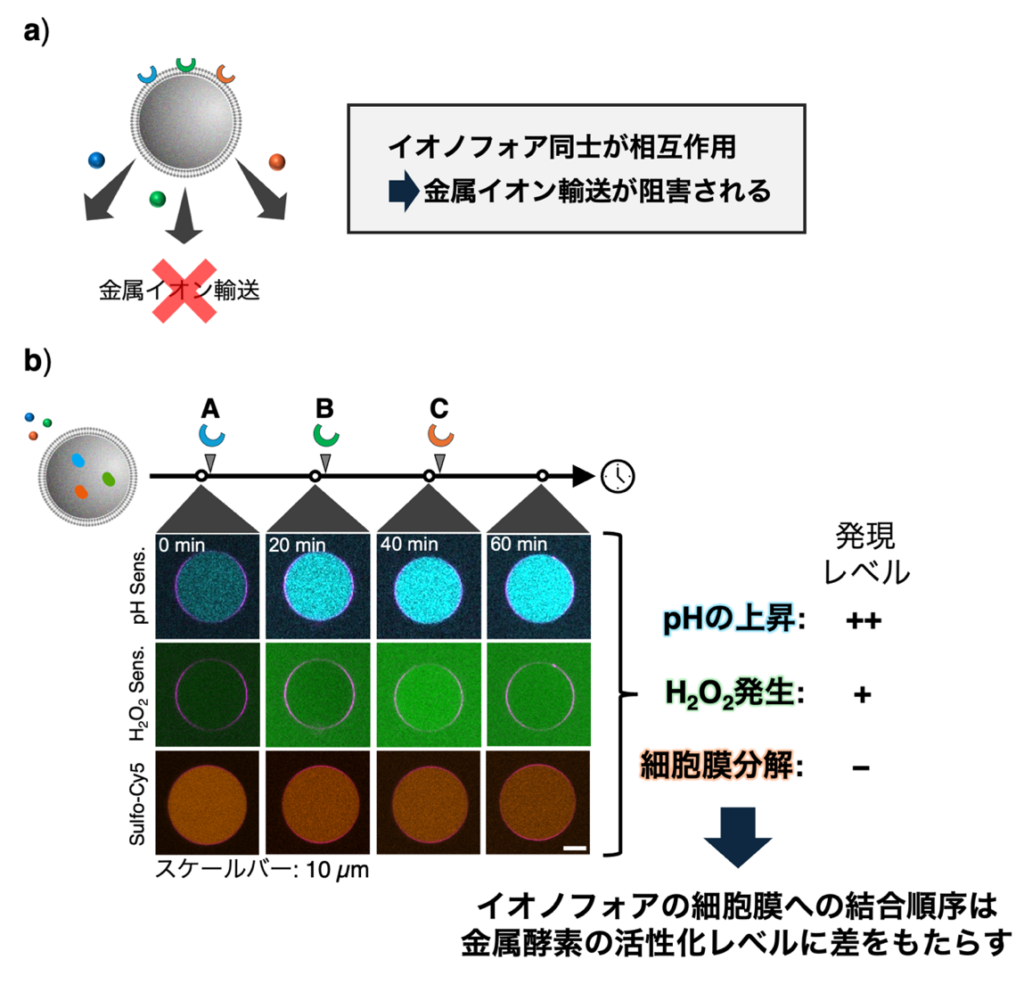
一方、3種類のイオノフォアを同時に細胞膜に結合させると、いずれの金属イオン輸送も抑制されることが明らかになった。分子動力学 (MD) シミュレーションの結果、細胞膜内でイオノフォア間に相互作用が働くことで細胞膜内での移動が抑制され、金属イオン輸送を妨げている可能性が示唆された。
さらに、3種類のイオノフォア (A, B, C) を異なる順序で細胞膜に結合させると (例: A→B→C、B→A→C など)、後から細胞膜に結合したイオノフォアに対応する金属酵素の活性化レベルが顕著に低下することを発見した (図2)。
すなわち、細胞膜に結合するイオノフォアの順序が金属酵素の活性化レベルに影響を与えることを発見した。
これらの結果から、開発した人工細胞においてイオノフォアが細胞運命の決定因子として機能し、最初に活性化された金属酵素が人工細胞の運命を定め、他の経路の活性化を抑制する仕組みが実証された。
開発した人工細胞は、外部刺激 (金属イオン) を細胞内部に届けるトランスポーター (イオノフォア) の選択によってのみ異なる機能を発現するシステムである。実際の細胞では、細胞膜に多種多様な膜タンパク質が発現した状態から外部刺激が入力されることで細胞は特定の反応を示すため、厳密に言えば実際の細胞と開発した人工細胞では外部刺激に対する応答方法が異なる。だが、異種イオノフォア (AとB, AとC など) が細胞膜内で互いに金属イオン輸送を妨げるという新たな発見により、細胞膜へのイオノフォアの結合順序が人工細胞の運命を左右するというさらなる発見にもつながった。ある機能が発現すると同時に潜在的に持つ他の機能発現が抑制されるこの現象は、細胞の初期状態である多能性幹細胞の細胞分化で見られる制御機構と類似するという見方もできる。従って、同研究が細胞分化を模倣した『多能性人工細胞』の設計に重要な指針を与えるものと期待される。