MPS開発の鍵は細胞で構成する界面の再現

近年、創薬研究の動物実験代替手法としてMPS(Micro physiological System=生体模倣システム)が注目されている。群馬大学大学院教授の佐藤記一氏(理工学府・分析化学研究室)は薬物動態解析のためのMPS開発を目指す研究者だ。腎臓や腸管などの単独臓器モデルと複数の臓器モデルを連結した生体モデルの開発を進めるとともに、産業化を前提にMPSの冷蔵流通技術開発にも力を注ぐ。
佐藤氏は「薬物が口から胃を通って腸から吸収され、肝臓、筋肉や脂肪組織、腎臓、心臓などを循環していく動態全体を1枚のデバイスで再現できれば、動物実験は不要になるのではないか」と究極のMPSについて話す。
続けてMPSに搭載する細胞の培養で重要なポイントとして、「ほとんどの臓器は単なる肉の塊ではなく、細胞による界面(2つの物質の境目)の集合体である。塊のように見える肝臓でも肝細胞は薄い二層程度で、張り巡らされた毛細血管との間に界面がある。MPSでも界面を再現する必要がある」と指摘する。2次元的な界面をつくる方法としては、多孔質膜やハイドロゲルの表面で細胞培養する方法があり、3次元的に界面をつくる方法としてはハイドロゲル内部で細胞培養する方法がある。
また、細胞外マトリックス(ECM)で細胞をコーティングする技術や、毛細血管を再現し、培養液を灌流させる技術も必要である。佐藤氏はこれらの要素を一つ一つ研究し、それらを組み合わせて最適なMPSの開発を目指した。
2次元MPSと3次元MPSには一長一短があるが、操作しやすく、観察や分析が容易であることから、佐藤氏がまず開発したのは2次元的なMPSデバイスである。透明な上下2本のマイクロ流路の間にメンブレンフィルターの膜を挟んだ構造で、膜の上と下に2種類の細胞を培養し、界面を再現した(図1)。
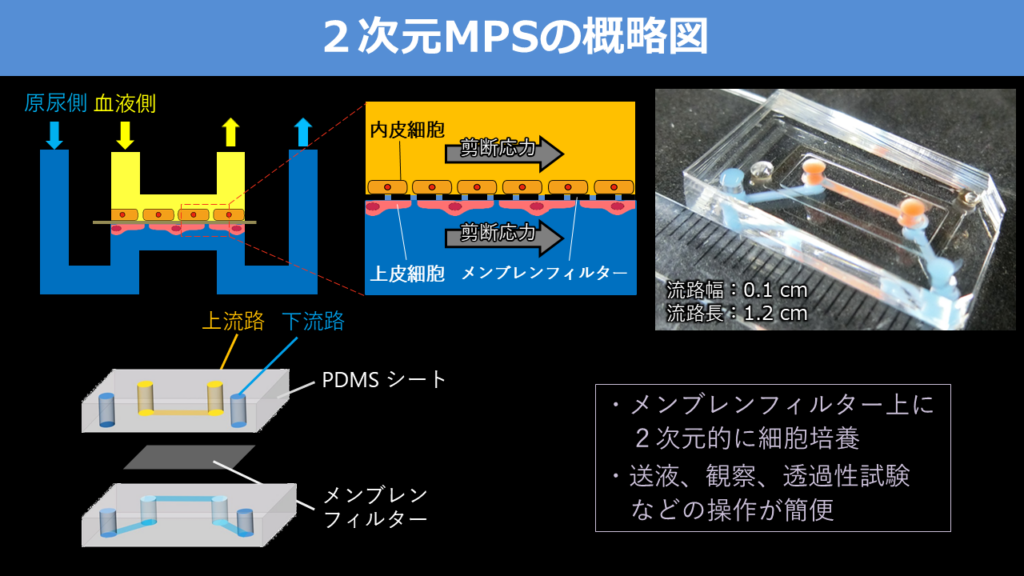
一例として、佐藤氏はフィブロネクチンとコラーゲンでコーティングした膜の上側にヒト糸球体内皮細胞、下側にヒト蛸足(上皮)細胞を培養し、2次元の腎臓糸球体モデルを構築した。同糸球体モデルで分子量6万6000のタンパク質と622の低分子化合物を混ぜた溶液を用いてろ過機能を試験してみると、低分子化合物は上流路(血液側)から下流路(尿管側)に通過したが、タンパク質は通過できず、ろ過機能があることが証明された。
「例えば、このモデルに腎毒性を持つ薬を流せば糸球体内皮細胞が障害され、タンパク質も通過するようになる。それに対して、治療薬を流すと糸球体内皮細胞が修復されてろ過機能が回復する。こういった腎毒性の試験にも有用と考えている」と佐藤氏。
培養する細胞を変えることで別の臓器を再現することもできる。佐藤氏は上流路を消化管に、下流路を血管に見立て、口から胃、十二指腸、小腸まで複数のプロセスを再現したマイクロ消化吸収モデルを構築した。細胞培養したのは小腸部分のみであるが、胃部分で人工胃液、十二指腸部分で中和液や人工腸液などを添加することで消化管全体を再現した。
さらに、佐藤氏はマイクロ消化吸収モデルに肝臓の代謝モデルを連結した消化吸収代謝モデルを構築し、抗がん剤の薬物動態試験を実施した。例えば、乳がんの治療に用いられるプロドラッグが消化吸収と肝代謝を経て最終的にどの程度の活性を示すのかが、1枚のMPSで試験することができるという。佐藤氏は「生体全体のモデルとしては原始的なものではあるが、一連のプロセスをつなげて分析することで、相互作用などが分かることもあると考えている」と説明する。
また、佐藤氏はハイドロゲル内で細胞培養する3次元MPSの開発にも着手。ゲル中で血管内皮細胞を培養して3次元的な毛細血管ネットワークを構築するところまでは成功し、現在は毛細血管ネットワークに接して臓器細胞を培養する研究を進めている。
-4℃の過冷却冷蔵でMPSを細胞ごと保存する
佐藤氏が注力するもう一つの研究テーマが「MPS産業化のための冷蔵流通技術開発」である。現在のところ、製薬企業などのユーザーがMPSを使用する場合、通常は購入したデバイスにユーザーの研究者が培養した細胞を植えてMPSを再構築する作業が必要であるが、「ユーザーからは細胞が植え付けられたMPSを購入したいというニーズがあり、MPSの普及には生産現場からユーザーまでの輸送と一時保管技術の開発が不可欠」と佐藤氏は指摘する。
通常、細胞は懸濁液の状態なら凍結して長期保存できるが、MPSごと凍結保存すると死滅してしまう。細胞を培地に蒔いて37℃で培養している状態では実験に適したピークの時期は2~3日である。現在も細胞が植えられたMPSが販売されることもあるが、それが可能であるのは特に丈夫で長持ちする一部の細胞に限られるという。
佐藤氏は「実験に適したベストな状態で冷蔵保存して輸送し、37℃に温めればすぐに使える技術、1週間程度はベストな状態を保持できる技術はないものか」と考え、さまざまな方法を試行するようになった。そんな時期に知ったのが、自販機などの冷蔵機器メーカーとして知られるサンデン・リテールシステムが新規に細胞関連事業を立ち上げ、精密な温度管理が可能な冷蔵機能を付加したCO2インキュベーターを開発したことである。
佐藤氏は、同社と共同でMPSの冷蔵流通技術開発を進めるようになった。「この装置は冷やしたり、温めたりする速度を精密にコントロールできるため、細胞を凍らせずに機能を保ったまま保存することが可能ではないか」と考えたからだ。
冷蔵保存条件の検討を重ねたが「ある程度、活性の高い細胞は4℃では完全には眠らない。凍結させずにどこまで冷やせるかを検討し、-4℃の過冷却冷蔵保存がベストであるとの結論を得た」と佐藤氏。ただ、冷蔵保存条件も細胞によって違うという。2次元培養したヒト肝細胞株の場合は24時間かけて37℃から-4℃まで冷却し、40分かけて37℃に復温させるという条件で過冷却保存すると、2週間まではほぼ100%生存していることが確認できた(図2)。
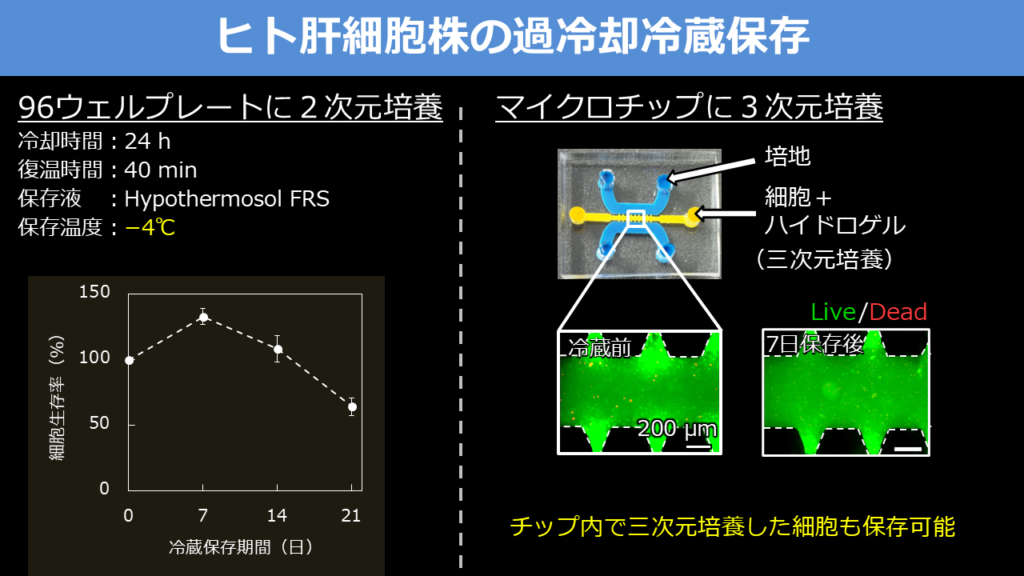
3次元培養した場合も1週間はほぼ100%生存することを確認している。佐藤氏は現在、さまざまな種類の細胞で冷蔵保存条件の検討を進めているところで、「近い将来、細胞の植え付けられたMPSごと製薬企業などに届けられるようになるだろう」と期待している。
また、将来の研究の方向として、複数臓器モデルを接続して相互作用などを調べる人体全体のモデル化を進めるとともに、「個人個人が健康なうちに細胞を採取してiPS細胞のような形で保存しておき、病気になったときに治療法を検討できるような個人化したマイクロ人体モデルを開発したい」と佐藤氏は夢を語った。


