
薬物代謝酵素として有名なシトクロムP450は、還元状態で一酸化炭素と結合して450nmに吸収極大を示す色素(pigment)であり、1962年に大阪大学蛋白質研究所の大村恒雄博士、佐藤了博士によって「シトクロムP450」と名付けた最初の英文原著が出された。シトクロムP450には多くの分子種(CYPファミリー)があり、ヒトや動物の体内でさまざまな化学物質の形を変える触媒として働く酵素であることが知られているが、昭和薬科大学教授の山崎浩史氏(薬物動態学研究室)は学生時代から42年間一貫してシトクロムP450の研究に携わり、分子種による反応の違いや、ヒトと動物の種差の解明を進めてきた。
山崎氏は岐阜薬科大学大学院を修了後、大阪府立公衆衛生研究所(現・地方独立行政法人 大阪健康安全基盤研究所)で化学物質の安全性や発がん性の研究に携わった。
「出身地である大阪から発信された世界的な研究成果であるシトクロムP450に興味を持った。この酵素群は我々の生活に密着して存在しており、薬毒物を水溶性物質に変えて排泄させ、生体を守る働きを持つが、一方でがん原性物質の代謝活性化にも関与することがわかっている。当時、多くの研究機関で喫煙による化学発がんのメカニズム研究が進められており、私もシトクロムP450を中心に化学物質の代謝や発がんの研究を進めることにした」と山崎氏は研究に入ったきかっけを語る。
山崎氏が行った研究の一つに、桜餅の香り成分であるクマリンの代謝研究がある。クマリンは殺鼠剤として利用されることから、アメリカではヒトへの適応は禁止されているが、ドイツでは一般用医薬品となっている。山崎氏はこれをP450の動物とヒトとの種差によるものと考えて、ヒトやネズミの薬物代謝酵素とクマリン代謝を研究した。
その結果、「クマリンがヒトCYP2A6によって解毒されるが、ラットにはこの機能がなく、別のCYP1A2によって毒性化されることがわかった」という。ヒトCYP2A6は遺伝子多型があり、日本人では同酵素を持たない人が100人中5人程度、存在することも明らかになっている。
「クマリンは一部の植物性サプリメントなどにも含まれているが、解毒と活性化とのバランスから肝毒性の懸念もあり、いわばラット型のタイプの人はそうしたサプリメントは摂取しないほうがよさそうだ」と山崎氏は指摘する。
CYP2A6は、タバコ煙中に含まれるニコチン由来がん原性物質ニトロソアミン類を代謝して活性化することが明らかになった。さらに山崎氏は金沢大学を経て北海道大学に移ってからもシトクロムP450と発がんの関連研究を継続したが、喫煙歴を有する多数の肺がんや大腸がん患者のCYP2A6遺伝子多型を調べ、野生型のCYP2A6遺伝子を持つ人の頻度と比べると、CYP2A6欠損変異を有する人の頻度は極めて少ないことを明らかにした。
山崎氏の一連の研究の基盤となったのが、1994年に論文発表した吸光度法を用いてヒトの肝臓に存在するシトクロムP450の総量と免疫学的に個別分子種を定量した研究である(図1)。日本人の肝臓30人分と米国から入手した肝臓30人分をすりつぶし、抗原抗体反応を利用した免疫学的定量法により各分子種の割合を明らかにしたものだ。
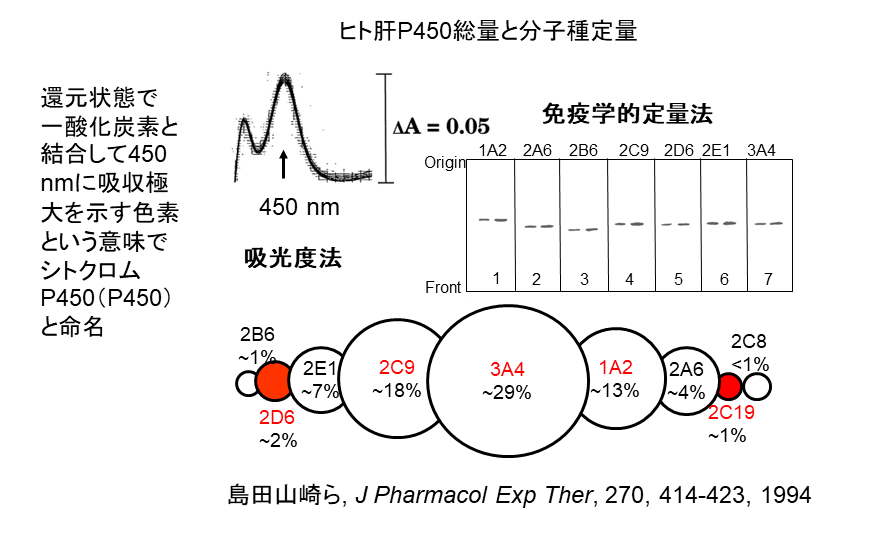
同研究で明らかになったヒトのシトクロムP450の分子種の割合は、最も多いCYP3A4が29%、次がCYP2C9で18%。以下、CYP1A2が13%、2E1が7%などと続く。
山崎氏は「この研究成果は現在では薬学の教科書にも載っているが、多くは一般的な円グラフで示されている。この原著論文の元データは円グラフではなく、表に分子種ごとの数値で示し、別途総説などでは円で表現した。これは一つ一つの円の大きさに個人差があることを示している。
さらに、各分子種の割合は遺伝的要因で固定されているわけではなく、食生活や薬物の摂取などの環境要因によっても大きく変化すると認識することが重要だ」と説明する。例えば、ステロイドはP450分子種の割合を変化させる代表的な薬物であり、別の薬物や化学物質の代謝に影響する可能性が高いという。
サリドマイド毒性の種差が生じる代謝経路を解明
山崎氏の昭和薬科大学異動後の近年の代表的な研究成果に、P450を介したサリドマイド代謝の種差の研究がある。サリドマイドは1950年代末から60年代初めにかけて多数の新生児奇形を生じる副作用被害を引き起こしたが、開発段階のネズミによる動物実験では胎児の催奇形性は確認されず、サリドマイドの催奇形性発現には種差があることがわかっている。サリドマイドの代謝にもシトクロムP450が関与しているが、山崎氏らは種差の解明をめざして、ヒトと同様に催奇形性を示すウサギ、サルやヒトの肝細胞を移植したヒト化肝臓マウス、催奇形性が認められない通常のラットを用いてさまざまな研究を行った。
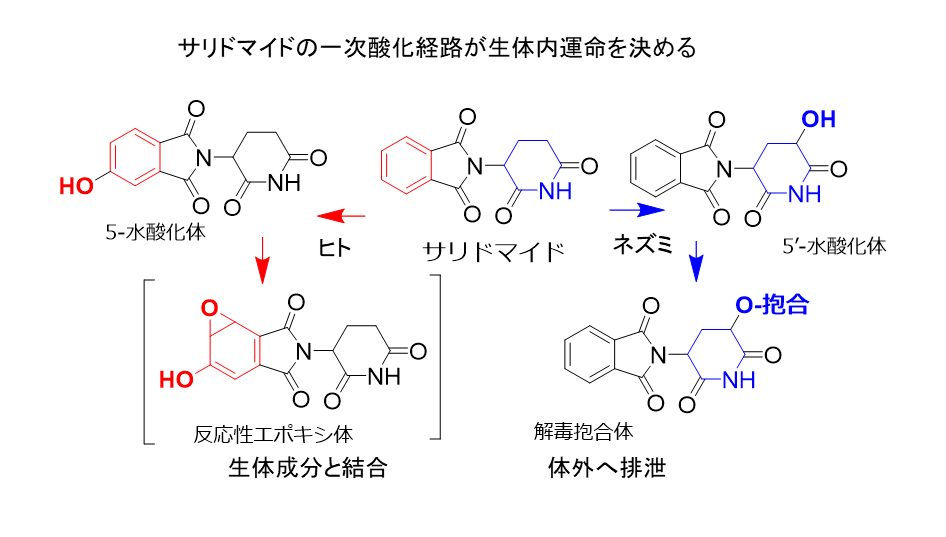
山崎氏らが解明したサリドマイドの代謝経路(図2)では、ヒトでは投与されたサリドマイドはCYP3A4が関与して芳香環が酸化されて5-水酸化体に変換され、さらに生体成分と結合して排泄されにくい反応性エポキシ体に速やかに変換される(赤矢印の経路)。
一方、ネズミでは分子種ははっきりと確定されていないが、別のCYP2C分子種が速やかに5’-水酸化体に変換し、グルクロン酸抱合体や硫酸抱合体となって効率よく体外に排泄するため(青矢印の経路)、毒性は観察されない。
ヒトと同じ薬物代謝酵素活性を示すヒト化肝臓マウスに、ウサギで奇形を起こす最低量のサリドマイドを投与すると半数が死亡した。ヒト胎盤やヒト遺伝子を導入したマウス胎児でのサリドマイドの活性化にP450が関与することも確認している。
これらの研究から、山崎氏は「サリドマイドの毒性発現はP450が関与する一次酸化経路によって決まる」と結論付ける。サリドマイドは2008年に多発性骨髄腫治療薬として承認され、第二世代のサリドマイド系薬剤としてレナリドミド、ポマリドミドも上市された。
これらの薬剤は胎児への薬剤曝露防止を目的として患者とパートナーに避妊期間を指導するなど厳格な管理手順のもとで服用されている。山崎氏は「代謝の観点から第二世代の薬剤はサリドマイドより安全性が高いと考えているが、現在のところ製薬企業により国際的に統一された管理が成されている」と説明する。一方、日本においては「2023年2月に‟医薬品の投与に関連する避妊の必要性等に関するガイダンス”が発出され、結果的には管理を緩和する方向になりつつあると読める。さらに薬物代謝と安全性の研究を進めていきたい」と話す。
山崎氏は「今日ではシトクロムP450の各分子種の試薬が開発されて簡単に化学物質の代謝が調べられるようになったが、各酵素の特性まで深く理解されているわけではない。『P450の研究は完成に近く、研究テーマとして魅力がない』と言う人もいるが、伝統的な知見に新しい技術を活用することでまだまだ革新的な研究が展開できると考えている」と強調する。
P450の遺伝子検査は研究用では既に実現し、米国では臨床現場でも遺伝子検査を行って薬剤の選択や投与量調整に生かすことも多いという。日本では体外診断薬の保険収載の問題から臨床現場ではほとんど実施されていないが、「シトクロムP450の研究成果がもっと臨床の現場にも知られるようになれば、いずれはP450関連遺伝子を網羅的に検査し、薬剤の選択や用量調整を行うような時代が来るのではないか」と山崎氏は話している。


