
東京医科歯科大学難治疾患研究所先端ナノ医工学分野の内田智士教授の研究グループは、ナノ医療イノベーションセンター(iCONM)、京都府立医科大学、杏林大学、東京大学との共同研究で、脾臓にmRNAを送り届けるナノ粒子を開発し、mRNAワクチンとしての有用性を実証した。同システムは、マウスにおいて、優れたワクチン効果を示したことから、今後、がん免疫治療などへの医療応用が期待される。
同研究は、文部科学省科学研究費補助金ならびに国立研究開発法人日本医療研究開発機構(AMED)の支援のもとでおこなわれたもの。研究成果は、Wiley が発刊する国際科学誌Small Science 誌に、2024 年 2 月 22 日にオンライン版で発表された。
RNAを静脈内に投与して脾臓に送達することで、全身性の免疫を効率的に誘導できる手法が知られていた。がん免疫治療の分野で近年注目されているがんワクチンとしての応用が期待されている。mRNA を送達する方法として、新型コロナウイルスの mRNA ワクチンでも用いられたような脂質からなるナノ粒子が主に用いられている。
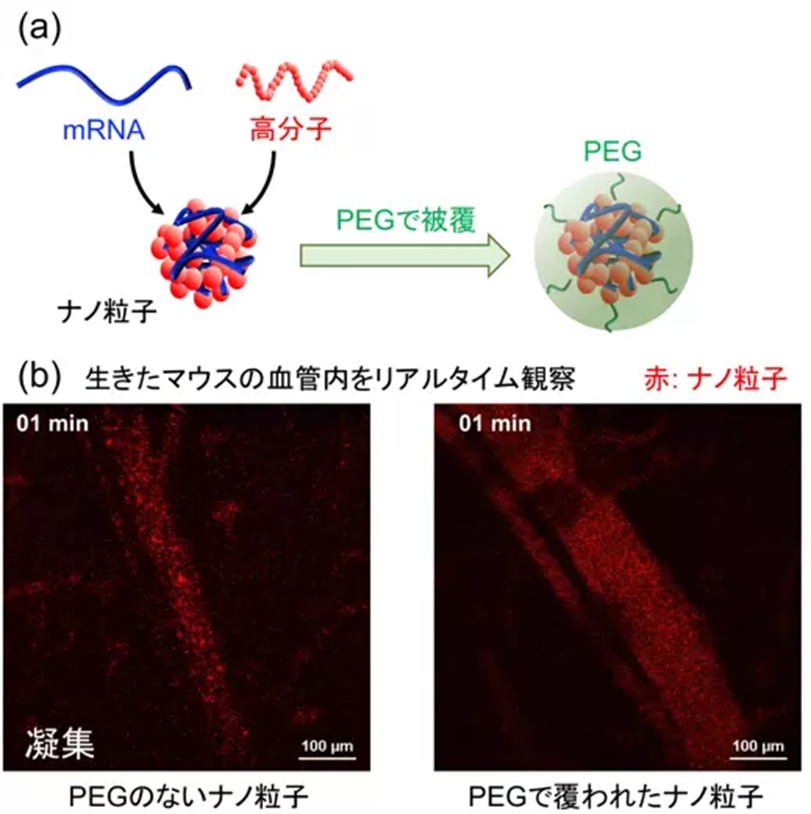
だが、脂質性のナノ粒子は肝臓へ移行しやすい性質を持つほか、炎症反応を惹起することで副反応を起こしやすいといった課題があった。高分子からなるナノ粒子は、これらの課題を克服する手法として期待されている。正電荷を持つ高分子と負電荷を持つ mRNA を混合して得られるナノ粒子が長年開発されてきました(図 1a)。
だが、このナノ粒子は、そのままでは血液中のタンパク質、血小板などと結合し、大きな凝集塊を形成し、肺の血管を閉塞させてしまう(図 1b 左)。すると、脾臓などの標的組織に mRNA を送達できないだけでなく、このような肺塞栓は重篤な副作用の原因となる。
一方で、ナノ粒子の表面を PEGで覆うと、周囲の分子、細胞のナノ粒子への吸着を防ぐことができ、この課題を解決できる(図 1b 右)。だが、ナノ粒子を過剰にPEGで覆うと、標的の細胞とナノ粒子の結合も阻害され、mRNA は標的細胞に送達されなくなってしまう。
従って、ナノ粒子を適切な量の PEG で覆う方法が必要となる。だが、高分子ナノ粒子表面の精密なPEG 密度の制御は難しく、これまで高分子ナノ粒子を用いた脾臓への mRNA 送達は、ほとんど検討されて来なかった。
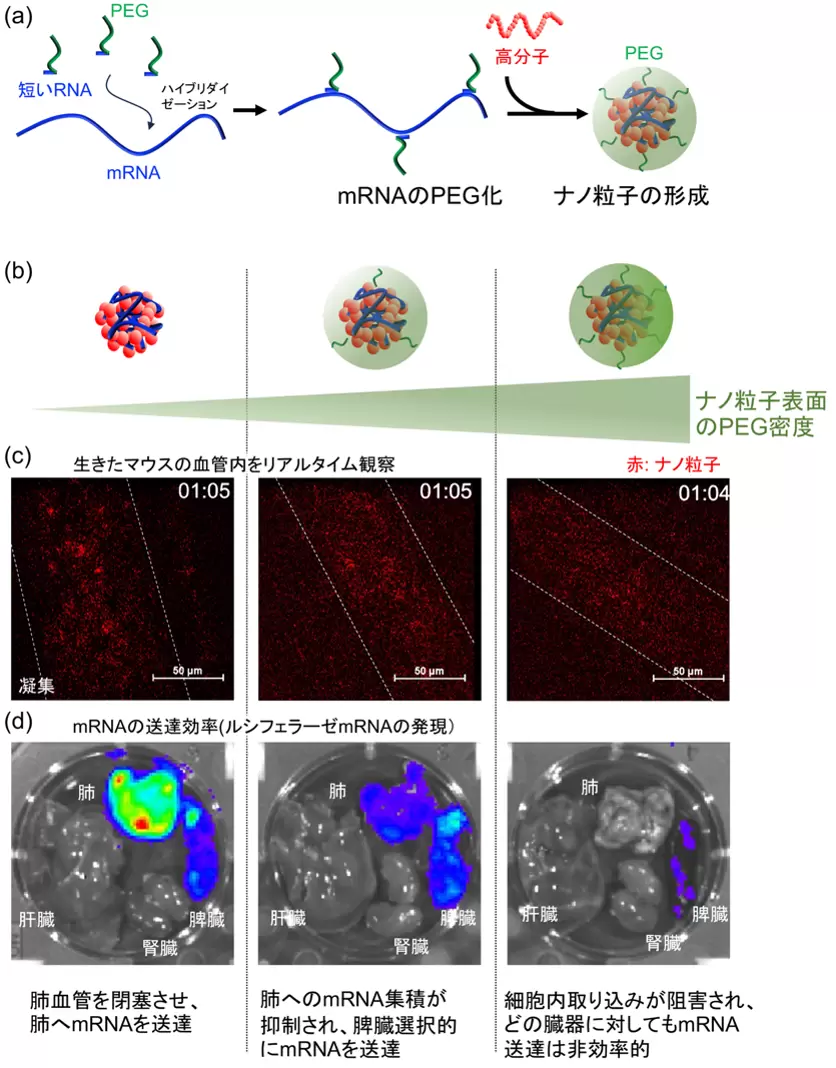
今回、研究グループで開発を進めてきた mRNA工学の手法を応用した。実際には、まずPEGと結合したRNA(PEG-RNA)をハイブリダイゼーションによりmRNAに結合させ、mRNAに PEG を結合させる(図2a)。この方法では、PEG-RNAはそのRNA配列に対応して、mRNA 鎖上の 1 箇所にのみ結合する。
PEG-RNAの配列の種類に応じて、決まった数だけ PEG-RNA が結合した mRNAを調製することができる。その後、高分子と混合することでナノ粒子を調製する。
この方法では、mRNAに結合させるPEG の数や長さを変えることで、簡便かつ精密にナノ粒子表面の PEG密度の制御が可能になる。
そこで、表面の PEG の密度や長さの異なる様々なナノ粒子を調製し(図 2b)、マウスへ投与することでその機能を調べた。生きたマウスの血管を直接顕微鏡観察したところ、PEG のないナノ粒子や、十分に PEG で覆われていないナノ粒子は、血液中に投与してから 1 分以内に大きな凝集塊を形成していた(図 2c)。結果的に、肺の血管を閉塞させ、肺に mRNA を送達していた(図 2d)。
他方、、PEG 化することで、血液中での凝集や、肺血管の閉塞を防ぐことができた(図 2c)。だが、長いPEGや高密度のPEGで被覆したナノ粒子は、細胞との接着が抑制されるため、全身のどの臓器の細胞に対しても、mRNAを効果的に送達することができなかった(図 2d)。その一方で、適切な密度のPEGで被覆したナノ粒子は、脾臓の細胞に効率的にmRNAを送達していた(図 2d)。
より詳細に調べたところ、脾臓の中でもワクチンで重要な役割を果たす抗原提示細胞にmRNAが効率的に取り込まれていることが分かった。そこで、ワクチンとしての機能を評価したところ、細胞性免疫が強く誘導されていることが分かった。この細胞性免疫は、がん免疫治療においてがん細胞を殺傷する上で重要とされているため、がんワクチンとしての応用が期待される。
mRNAを生体に投与し、医療応用を目指す際には、ナノ粒子に搭載しmRNAを分解から保護し、標的の臓器に送り届ける必要がある。これまで、脂質を用いたmRNA送達ナノ粒子が主に用いられてきたが、脂質は、生体内での動態や安全性に課題を残している。mRNAの医療応用を拡大させる上で、目的に応じて送達手法に関する他の選択肢も必要である。
今回、高分子を用いた mRNA 送達システムのワクチンへの有用性の実証により、今後、より安全かつ効果的なワクチン開発を目指す上での礎を築くことができた。今後、システムの更なる機能向上や、がんなど疾患モデルへの展開により、実用化を目指す。
また、mRNA送達の研究では、脂質や高分子などの開発が主に行われてきたが、mRNA の設計に着目した研究はほとんど無かった。同研究は、研究グループが開発を進めてきた mRNA 工学を用いた mRNA送達システムの開発という点でも、独自性と重要性を有する。


