感染防御や創薬、真核生物のもつ免疫機構解明に期待
岐阜大学医学部の永井宏樹教授、東京薬科大学生命科学部の新崎恒平准教授の研究グループは、病原細菌が宿主因子に多層的な化学修飾を与えることで経時的に増殖液胞の状態をコントロールする仕組みを明らかにした。
同研究では、これまでに知られていない特殊なユビキチン修飾が介在した制御機構が発見され、ユビキチンバイオロジーに新たな光が与えられた。これら研究成果は、8月8日に生命科学・生物医科学分野のオープンアクセスジャーナルであるeLife誌のオンライン版で発表された。
人に重篤な肺炎を引き起こす病原細菌であるレジオネラは、感染宿主細胞内で働く酵素群を300種以上も保有するという他の細菌には見られない特徴を持っている。
これらの酵素群の中には特に、「ユビキチン」という小さなタグをタンパク質に付与する「ユビキチン化」反応において、新規反応機構が多く見出されていることから、レジオネラは「ユビキチン研究の宝庫」として注目されている。
レジオネラは、細胞に侵入して細胞の中で特殊な液胞を構築し、それを生存・増殖の場としている。レジオネラが細胞内で増殖することが、感染宿主(ヒト)の発症の直接的要因となるため、増殖を引き起こすメカニズムの解明が感染防御の上で喫緊の課題となっている。
レジオネラの細胞内増殖に関わる宿主因子の探索は世界中で広く行われてきたが、近年、細胞内の膜輸送に関わる低分子量GTPアーゼのひとつであるRab10の重要性が指摘されていた。
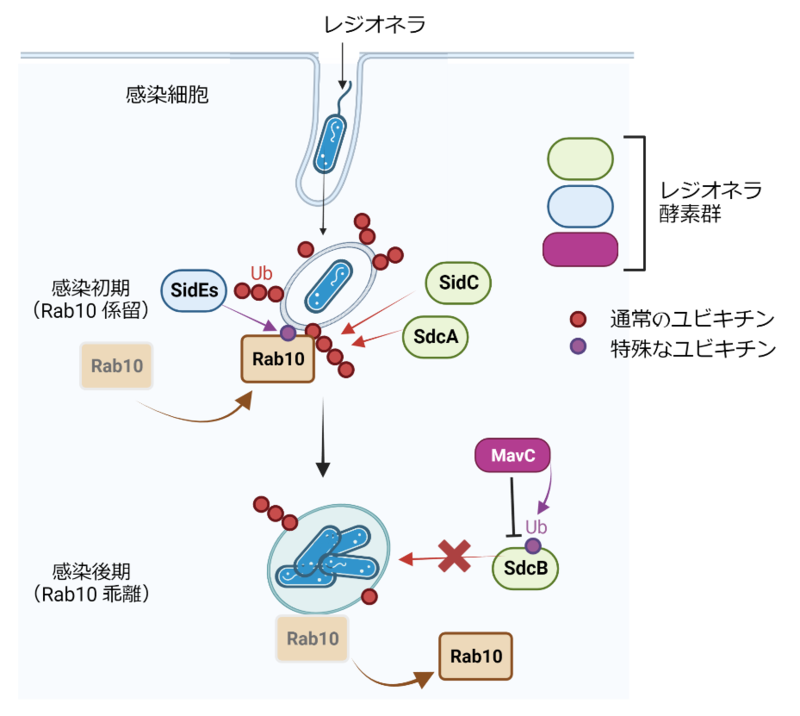
Rab10は、レジオネラ酵素によってユビキチン化され、レジオネラ液胞に係留されることが報告されていたが、その詳細なメカニズムは不明であった。
レジオネラが持つ古典的ユビキチンリガーゼ群SidCファミリー(SidC, SdcA, SdcB)のうち、SidCとSdcA は感染初期にレジオネラ液胞に局在し、Rab10をポリユビキチン化することが報告されていた。
同研究により、そのユビキチン化の基盤となるのは、別のSidEファミリータンパク質群(SidEs)によるホスホリボシル化ユビキチン修飾)という特殊な化学修飾であることが示された。
Rab10のポリユビキチン化は、液胞にRab10が局在するという現象を伴って観察されたことから、ユビキチン鎖を介してRab10は液胞膜に係留されると考えられた。
同研究ではさらに、感染後期にはSdcBがRab10のポリユビキチン化を促し、Rab10を液胞上に係留し続けようとすることがわかった。
一方、別のレジオネラ酵素であるMavCは、SdcBに対して特殊なユビキチン修飾を施すことが見つかった。質量分析解析により、その修飾はMavCが持つトランスグルタミナーゼ(グルタミン転移)活性によってユビキチンのグルタミン残基がSdcBのリジン残基と共有結合した結果起こる特殊なユビキチン修飾であったことが明らかとなった。
この特殊な化学修飾によってSdcBのユビキチンリガーゼとしての本来の機能は損なわれ、結果として、感染後期にはRab10のポリユビキチン化は減弱し、レジオネラ液胞から乖離することが示された。
同研究結果を通じて、古典的ユビキチン化反応に対してホスホリボシル化ユビキチン修飾がその介助をし、一方でグルタミン転移によるユビキチン修飾がその抑制に働くという、異なる3つのユビキチン化反応が多層的に作用するという構図が見出された。
このような多重制御があるために、レジオネラはターゲットである宿主因子の挙動を時間空間的に巧妙に操ることができると考えられる。こうした複雑な仕組みは数多くの酵素を産生するレジオネラだからこそ実現できるものなのかもしれない。
真核細胞にも多くのタンパク質ファミリーが存在し、分子構造のわずかな違いが異なる化学反応をもたらす例が多く知られているが、微生物の生存戦略は人間の想像を超えた様々な化学反応によって支えられていることが明らかとなってきた。
病原細菌の感染機構の解明を通じて、まったく未知の化学反応が今後も引き続き発見されると考えられ、それが感染防御や治療のための創薬に応用され、ひいては、ヒトを含めた真核生物のもつ免疫機構の解明にも結び付くものと期待される。


