GIP受容体作動薬・GIP/GLP-1二重受容体作動薬で代謝改善が期待される糖尿病・肥満者の予測、選択への応用に期待
関西電力医学研究所統合生理学研究センターおよび岐阜大学医学系研究科糖尿病・内分泌代謝内科学の矢田俊彦センター長らの研究グループは2月28日、マウスを用いた研究で、インクレチンGIPの受容体作動薬が過食・肥満・糖尿病を改善することを解明したと発表した。
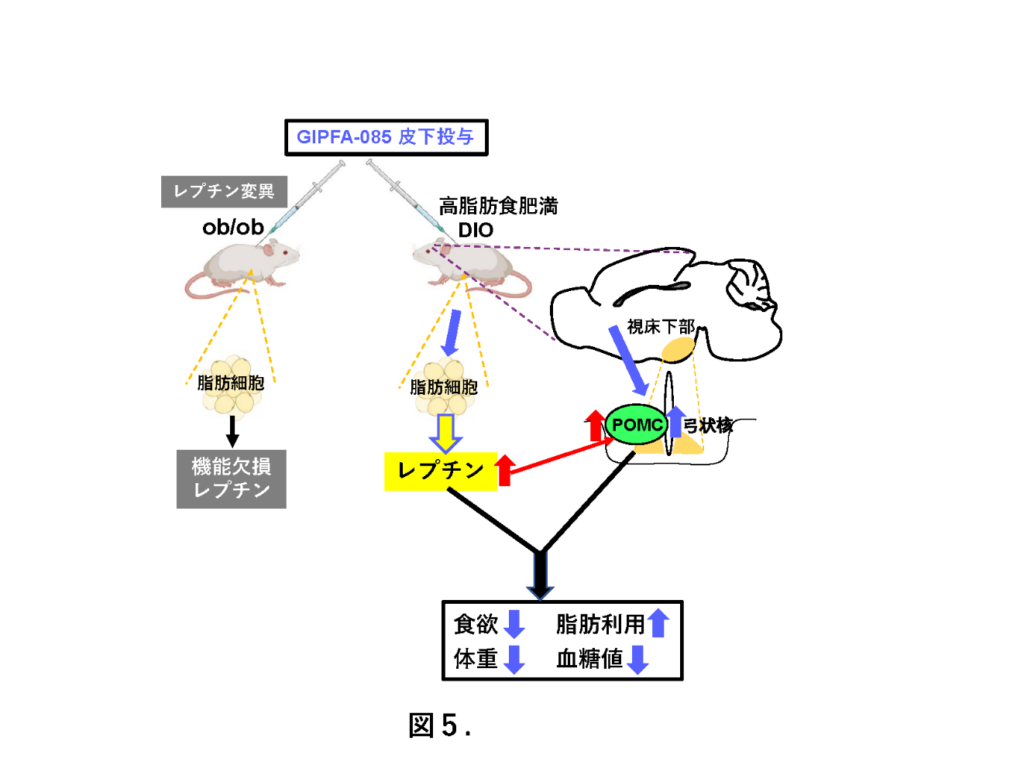
同薬がレプチン分泌を引き起こし、弓状核神経・POMC神経を活性化し、摂食抑制と脂肪利用亢進を介して体重を低下させ、血糖を制御し、食事性肥満・糖尿病を改善するメカニズムを発見したもの。
同研究成果は、2月28日にDiabetes Obesity And Metabolism誌のオンライン版で発表された。
食事に伴い消化管から分泌され、膵に作用してグルコース誘発インスリン分泌を促進する生体ホルモンのインクレチンには、グルカゴン様ペプチド1(Glucagon-like peptide-1; GLP-1)とグルコース依存性インスリン分泌刺激ポリペプチド(Glucose-dependent insulinotropic polypeptide; GIP)がある。
これらは、生体の分解酵素で速やかに切断されるため、分解酵素耐性の分子修飾をした長時間作用型の受容体作動薬として用いられている。GLP-1受容体作動薬は、糖尿病治療薬として広く用いられ、血糖降下に加えて体重・摂食低下作用を示し、米国では肥満への適用が承認されている。
一方、GIPと肥満の関連が指摘されてきたにも関わらず、GIP受容体作動薬は単独およびGLP-1受容体作動薬との併用で体重・摂食低下を示すため、GLP-1パラドックスとして注目されている。
GIPパラドックスの解決には、GIPの体重、摂食への効果と作用機序の解明が不可欠である。そこで、矢田氏らは、安定(半減期>6時間)で特異的なGIP受容体作動薬であるGIPFA-085を肥満・糖尿病マウスに皮下投与し作用を調べた。
摂食・代謝の司令塔である視床下部弓状核神経細胞に対するGIPFA-085の作用を、Ca2+イメージングにより測定した。
高脂肪食負荷肥満(DIO)マウスにおいて、GIPFA-085皮下投与は、投与1時間後から糖負荷試験での血糖値と摂食量(図1b)を低下させ、血中レプチン濃度を増加させ(図1a)た。
GIPFA-085(300 nm/kg)を連日投与すると、投与後1-3日目で摂食量が低下(図2d)、呼吸商8)が低下(脂肪利用亢進)し(図2e,f)、1-12日目で血糖値が低下(図2a)、3-12日目で体重が低下(4%)し(図2b,c)、投与中止後リバウンドは見られなかった。
一方、機能的レプチン欠損ob/obマウスではGIPFA-085は効果を示さなかった(図3)。GIPFA-085は弓状核のproopiomelanocortin(POMC)神経を含む満腹系神経を直接活性化し(図4a)、その際レプチンと協働作用を発揮した(図4b)。
同研究結果によって、GIPFA-085はレプチン分泌を引き起こし、レプチンとの協働作用により弓状核満腹神経、POMC神経を活性化させ、摂食抑制、脂肪利用亢進、体重低下を起こし、血糖を制御して、過食・肥満・糖尿病を改善することを明らかにした(図5)。
同研究グループは長年、インクレチンの研究を国内外で先導してきたが、今回新たに、(1)GIPの食欲抑制、肥満改善作用を明らかにし、(2)GIP受容体作動薬による新規インクレチン治療を確立。加えて、(3)GIP受容体作動薬の治療効果に、レプチン系の状態(分泌能、抵抗性)が影響することを明らかにした。
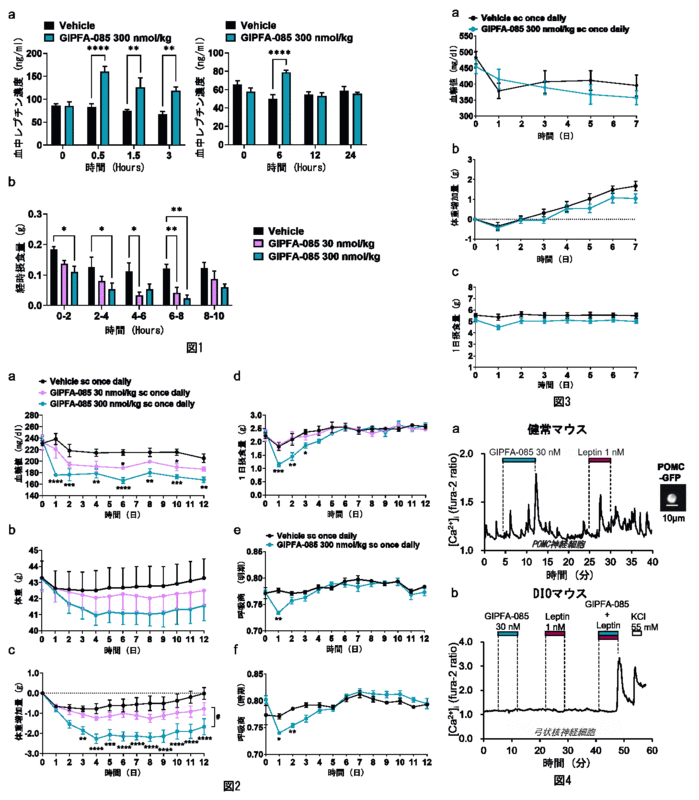
図2. GIPFA-085皮下投与は、DIOマウスの(a)血糖値、(b)体重、(c)体重増加量、(d)1日摂食量、(d)明期呼吸商、(d)暗期呼吸商を低下させる。
図3. GIPFA-085皮下投与は、機能的レプチン欠損ob/obマウスの(a)血糖値、(b)体重増加量、(c)1日摂食に有意な効果がない。
図4. GIPFA-085投与は、(a)視床下部から単離した弓状核POMC神経の細胞内Ca2+濃度を増加させ、(b)GIPFA-085とレプチンは相乗効果を発揮する。(a)健常マウス、(b)DIOマウス。
すなわち、GIPFA-085はレプチン分泌を引き起こし、レプチンとの協働作用により弓状核POMC神経を活性化させ、摂食抑制、脂肪利用亢進、体重低下を起こし、血糖を制御して、過食・肥満・糖尿病を改善することを明らかにし、GIP受容体作動薬による新規インクレチン治療を確立した。
今後は、GIP受容体作動薬(GIPFA-085)によるレプチン分泌促進の機序の解明:脂肪細胞のGIP-1受容体活性化によるレプチン合成および分泌を検証する。
さらに、GIP受容体作動薬による脂肪利用亢進(脂肪分解促進)機序を解明し、レプチンの脂肪細胞への直接効果、および交感神経活性化を介した脂肪細胞への効果の関与を解析する。
GIP受容体作動薬とGLP-1受容体作動薬の併用による強力な摂食・体重・血糖値低下の機序の解明や、協働作用発揮におけるレプチンの役割を検証。病態成因と程度が異なる糖尿病・肥満モデルマウスを用いて、レプチン機能(分泌、作用など)の質的・量的変化とGIP受容体作動薬の有効性の関係を調べる。これらの結果は、GIP受容体作動薬またはGIP/GLP-1二重受容体作動薬によって代謝改善が期待される糖尿病・肥満者の予測、選択につながるものと期待される。


