「実験動物飼育管理」、「実験動物技術者派遣」、「バイオ関連受託試験」、「研究用試薬提供」などを柱に事業展開するケー・エー・シー(本社:京都市)は、実験動物の生体内で種々の遺伝子を発現させることができるAAV(アデノ随伴ウイルス)ベクターの受託調製事業を本格的に開始した。
AAVベクターは、遺伝子導入ウイルスツールの一つで、基本、病原性を持たないため、P1レベル封じ込め基準で実験が可能であることを特徴とする。神経科学分野では主要な遺伝子導入ツールとなっており、ノーベル賞候補にあげられている研究者の研究領域であるオプトジェネティクスにも欠かせないツールである。また、筋肉や心臓、肝臓などの様々な臓器への遺伝子導入にも利用可能だ。
AAVベクターを用いて外来遺伝子を実験動物の生体内のある領域だけに発現させたり、特定の遺伝子の機能を増減させたりして、ヒトと同様の病態モデル動物が作成できる。簡易なTG(トランスジェニック)動物としてターゲット評価できるのが、AAVベクターの大きな利点の一つである。
具体的な手法には、生体内生理活性物質には反応せず、特殊な化合物にのみ反応するように改変した受容体を用いるDREADD法や、特定の波長の光に反応するようにデザインされた受容体を用いるオプトジェネティクス法などへの適応があり、これらの遺伝子改変受容体をAAVベクターで局所発現させ、DREADD用化合物や、光刺激によりシグナルをon/offして、病態を発症させることが可能だ。
最近、遺伝子治療でも、AAVベクターの使用(生体にウイルスを接種するIn vivo手法)が主流となってきた。創成期の遺伝子治療ではアデノウイルスベクターが用いられていたが、抗原性や細胞障害性のリスクがあり、最近ではあまり用いられていない。骨髄細胞など体外で接種して生体に戻す(ex vivo)手法では主にレンチウイルスが用いられているが、レトロウイルスも含めたこれらのウイルスはヒト遺伝子の染色体に入り込むため、がん化リスクが懸念されている。
これに対して、AAVは、ヒトの遺伝子の染色体に入り込まずに細胞質の中に留まるため、ゲノムへの挿入リスク(発がんリスク)が極めて低く、安全で使い易い。
加えて、アデノウイルスのような病原性もなく、抗原性の低さ、封じ込めレベルの低さ、安定的な長期発現(非分裂細胞)などの特徴より、近年AAVベクターの活用が進んでいる。
AAVはエピソームとして存在することで、染色体に組み込まれることなく長期安定発現が可能であることが特徴ではあるが、細胞分裂が活発な組織や細胞に感染させた場合、細胞分裂に伴いエピソームが分配され(組換えAAVエピソームは増殖できない)、細胞当たりの発現量が低下する。さらに、感染から十分な遺伝子発現まで1週間程度の期間が必要なため、一般的に、細胞が分裂増殖しているin vitro系ではAAVの使用は適していない(1日で細胞数が倍になれば、7日でx1/128に希釈されてしまう)。こうした理由からAAVベクターはin vivoでの遺伝子導入にその強みを発揮する。

下西学 新規事業推進室長兼試薬事業部担当部長は、「神経細胞などの細胞分裂しない細胞では、AAVは長期安定的に発現し、がん化のリスクもかなり低い」と説明する。
その上で、「例えば、脳神経系の働きを見たい時に、マウスに簡便に特定の目的遺伝子を挿入できる。特定遺伝子が生体内でどのような影響を及ぼすのかを調べるには、AAVベクターが最適である」とその利点を強調する。
AAVベクターは、従来、国内大手の受託作製を利用するか、研究者自身で作製するかしか手立てがなかった。最近では、海外にも発注出来るようになった。ケー・エー・シーも昨年11月より受託生産を開始し、AAVを用いた実験のハードルは格段に下がってきた。
AAVの調製は、HEK293細胞に、複数のプラスミドベクターを導入し、一過性に発現させたAAVを超遠心分離等で精製する方法が一般的である。
これに対して、ケー・エー・シーでは、尾藤晴彦東京大学医学部教授門下の奥野浩行鹿児島大学医学部教授の技術指導を受け、複数の抗AAV抗体カラムを用いたアフィニティー精製による調製を行っている。
下西氏は、「アフィニティー精製は、非常に高い精製純度が特徴である。とはいえ、超遠心と比べて大量調製は困難なため、当社のAAVベクターは、小規模の動物実験向けに調製している」と説明する。遺伝子治療についても「ターゲットを動物実験でバリデーションしてみたいと考えておられる研究者は是非お声がけ頂きたい」と呼びかける。
さらに、「当社のAAVベクター受託調製は、製作期間約2か月、現状での費用100万円程度なので、国内大手と比べて、制作期間で1/3、価格で1/2以下の対応が可能である」と強調する。
海外発注では、国内大手比で1/5~1/10程度の価格設定もあるが、別途、輸入手続きや輸送に追加費用が必要となる場合もある。受託調製費用については、まだコストダウンの余地が有り、要相談での対応が可能だ。
下西氏は、「KACでは栗東のバイオサイエンスセンター(BSC)で調製しており、配送トラブルはない。AAVベクターの純度にも自信を持っている」と言い切る。
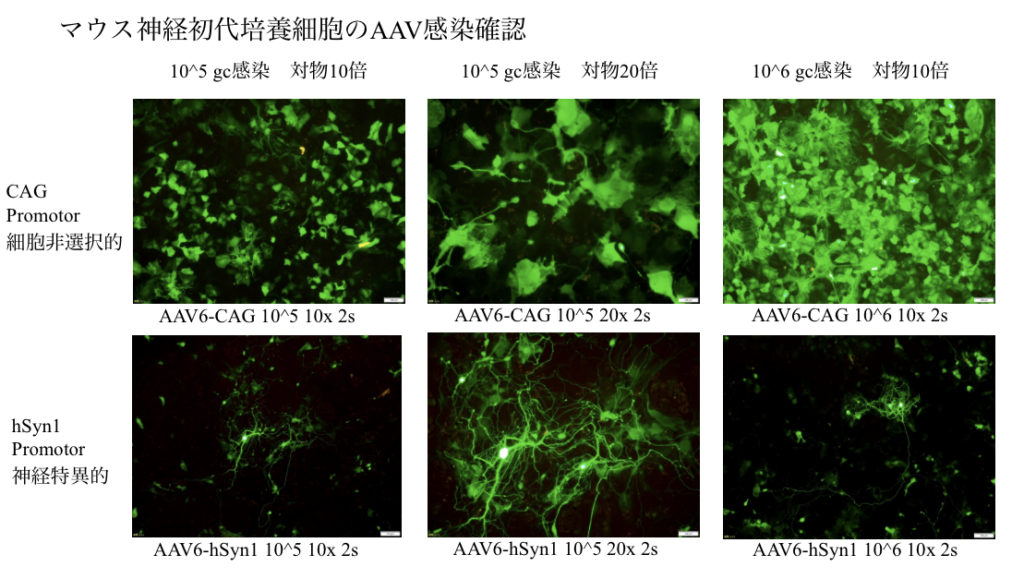
AAV感染確認用に「マウス初代脳神経細胞+培養セット」を無償提供しているのも見逃せない。ケー・エー・シーならではのサービスで、顧客自ら下の写真と同様のマウス神経初代培養細胞のAAV感染確認ができるので安心だ。加えて、BSCで作製したAAVを用いた薬理薬効試験の受託も可能である。
ケー・エー・シーにおけるAAV関連業務には、「AAVの受託調製業務」、「AAVを用いた薬効薬理評価試験」、「陽性コントロールとしてのAAV-EGFP感染動物の病理標本作製」ーがある。「これらの業務は、BSCで全て実施可能なのでスムーズに行うことができる」(下西氏)
同社のAAVベクター受託の流れは次の通り。
①導入遺伝子、血清型、プロモーターを決定
↓
②導入遺伝子を人工合成⇒ベクターに挿入(1カ月程度)
↓
③HEK293細胞に遺伝子導入⇒ウイルス液100mlと細胞を回収
↓
④精製・濃縮操作⇒力価測定 通常で3~10×1013 gc/mlを100 ul程度
力価は導入遺伝子により変動 (AAV2は1/10程度)
③~④の工程で約3週間
ケー・エー・シーでは、その他の新たなトランスモデル動物作成としてGONAD法(Genome-editing via Oviductal Nucleic Acids Delivery)にも取り組んでいる。
佐藤正宏鹿児島大学大学院・教授と大塚正人東海大学教授らの研究グループによって開発されたGONAD法は、卵管内の受精卵に対する電気穿孔分子導入を利用した画期的な遺伝子改変動物作製法である。従来の受精卵を取り出して胚操作を経て偽妊娠マウスの母体で出産させる手法と比較して、格段に迅速かつ簡便に遺伝子欠損や遺伝子改変を行える優れものの手法だ。
例えば、これまで遺伝子改変マウスはES細胞を用いて作製していたが、近年ではCRISPR法を用いることで効率良く作製できるようになった。ケー・エー・シーの担当者は、佐藤教授らの指導を受けてGONAD法の技術を習得しており、クライアントの施設内でCRISPR/Cpf1-GONAD法による改変動物作製も可能である。本年11月からは、同社のアニマルサイエンス事業部で、遺伝子型判定の交配、繁殖を実施する業務の拡大を計画している。
これらの業務の今後の見通してについて下西氏は、「AAVとGONAD法を組み合わせて、迅速な病態動物評価の推進を目指したい」と抱負を述べる。


