細胞の糖鎖構造変化解明によるがんなど糖鎖関連疾患の解明や治療薬開発に期待
岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦教授、平田哲也元特任助教らの研究グループは、広島大学との共同研究で、細胞が糖鎖の量や構造を調節する新たな仕組みを明らかにした。
この研究成果を契機に、今後、細胞の糖鎖の構造が変化する仕組みがさらに解明されれば、がんを始めとする糖鎖が関与する疾患の発症メカニズム解明や治療薬開発に貢献するものと期待される。
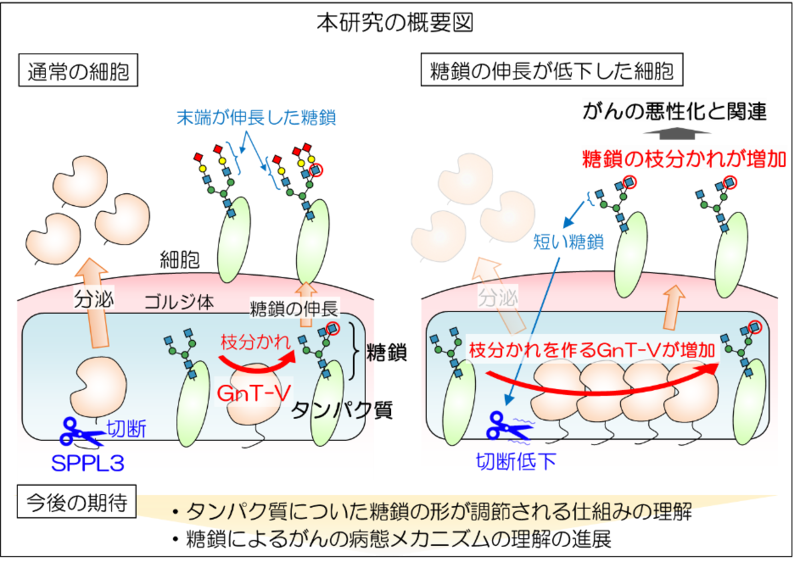
がんに関わる糖鎖を作る酵素GnT-Vは、細胞内のゴルジ体という小器官に存在しており、SPPL3という別の酵素で切断されることによって、細胞外に分泌されることが知られている。
同研究では、細胞の状態に応じて、GnT-Vの細胞外への分泌が止まり、その結果細胞内の量が増加することで、糖鎖を作る活性が増える事象が判明した。
同研究は、「特定の糖鎖の合成が細胞内でどのように調節されているのか」という疑問解明に向けて重要な知見を与えるとともに、糖鎖が関わるがんの悪性化の仕組みの解明にも役立つものと期待される。これらの研究成果は、8月1日付のNature姉妹誌「Communications Biology」に掲載された。
糖鎖とは、ブドウ糖などの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、タンパク質や脂質などに結合した状態で、細胞の膜を覆うようにして存在している。動物では、体内の半数以上のタンパク質に糖鎖がついている。タンパク質についている糖鎖には様々な形のものがあり、タンパク質ごとに形が異なることが知られている。
タ ンパク質につく糖鎖は、細胞の中で糖転移酵素(糖鎖合成酵素)と呼ばれる酵素の働きによって作られる。ヒトには、180種類ほどの糖転移酵素が存在しており、細胞は状況に応じてこれら糖転移酵素の量や活性を調節し、糖鎖の形を作り替える。
例えば、同じタンパク質でも、健康な状態と病気の状態では、ついている糖鎖の形が変化することが知られており、こうした疾患特異的な糖鎖の変化は、バイオマーカーとして実際に医療の現場でがんの診断などに使われている。
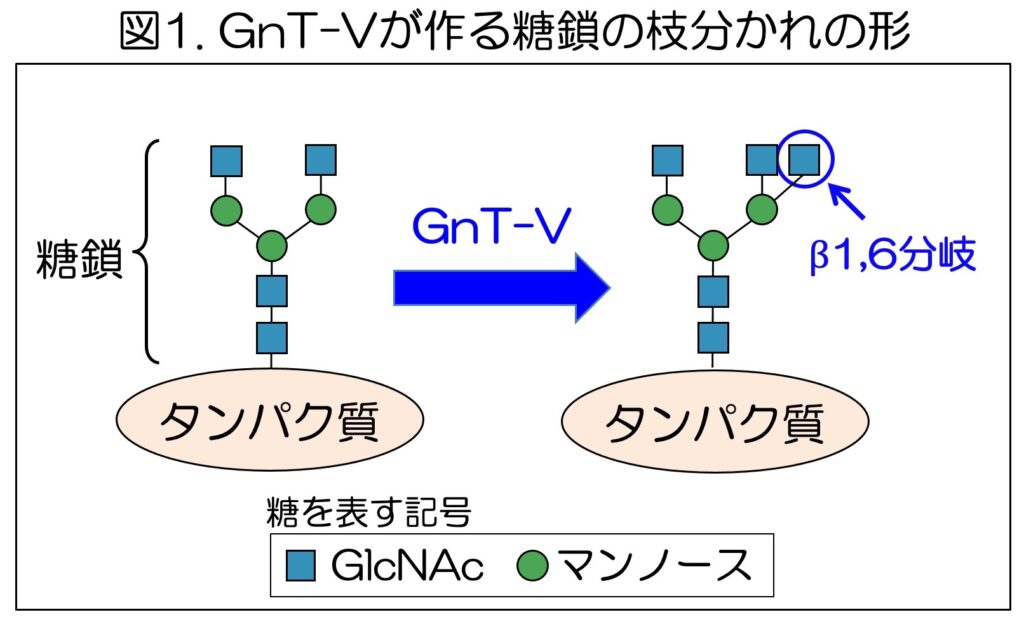
特に、糖転移酵素の一つであるGnT-Vが作るβ1,6分岐と呼ばれる枝分かれ構造は(図1)、がんの発症・進行に伴って増えることが知られている。さらに、GnT-Vの発現が高いがん患者では予後が悪くなる傾向を示すなどから、GnT-Vはがんの治療標的の一つと考えられている。
このように、細胞が自身の糖鎖を変化させること自体はよく知られており医療にも応用されているが、それがどのようにして起きるのか、その詳細な仕組みについてはまだあまりよくわかっていない。
最近の研究では、細胞が持つ多くの種類の糖鎖のうち一部の糖鎖をなくすと、一見無関係と思われていた別の糖鎖の量が変化することがわかってきている。
この事実は、細胞が自身の持つ糖鎖の形を検知し、それによって糖転移酵素が作る糖鎖の量を調節しているものと示唆される。
そこで木塚氏らは、細胞が持つ糖鎖の形が変化したとき、糖転移酵素の活性がどのように変わるのか、その仕組みの解明を目指した。
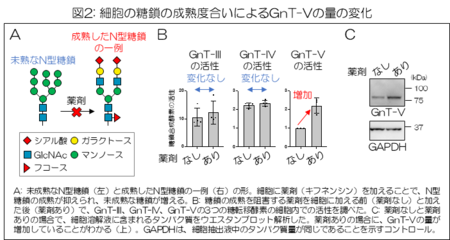
まず、細胞が持つ糖鎖の形を薬剤により変化させた。N型糖鎖と呼ばれる多くのタンパク質につく糖鎖は、未成熟な形から成熟した様々な形に細胞内で変化していく。
この成熟を阻害する薬剤で細胞を処理し、細胞のN型糖鎖を未熟な形のものに変化させた(図2A)。この細胞における幾つかの糖転移酵素の活性を測定したところ、薬剤を加えることで、細胞内のGnT-Vの活性が増加することがわかった(図2B)。
一方、GnT-Vとよく似た糖転移酵素であるGnT-IIIやGnT-IVの活性には変化がなかった。さらに、ウエスタンブロット解析によって細胞内のGnT-Vのタンパク質の量を調べたところ、こちらも薬剤処理によって増加していた(図2C)。
これらの結果から、細胞のN型糖鎖が未成熟な形になると、細胞内のGnT-Vの量が増え、その結果GnT-Vの酵素活性が増加することがわかった。また、この増加は全ての糖転移酵素に起こるのではなく、GnT-Vに選択的に起こる事象であると判明した。
次に、糖鎖の形の違いによりGnT-Vの量が調節される仕組みを調べた。GnT-Vなどのタンパク質は、メッセンジャーRNA(mRNA)6)から作られ、作られたあとのタンパク質は細胞内で分解されたり細胞外へ分泌されることが知られている。
つまり、mRNAの量によって細胞内で作られるGnT-Vタンパク質の量が決まり、分解や分泌の程度によって減少する量が決まる。
まず、通常の細胞と、未熟な形の糖鎖をもつ細胞を用いて、GnT-VのmRNAの量を比較し、合成される量に違いがないかを調べた。
その結果、GnT-VのmRNAの量には違いはなかった。次に、GnT-Vの細胞内での分解量を調べたが、GnT-Vはあまり分解を受けていなかった。
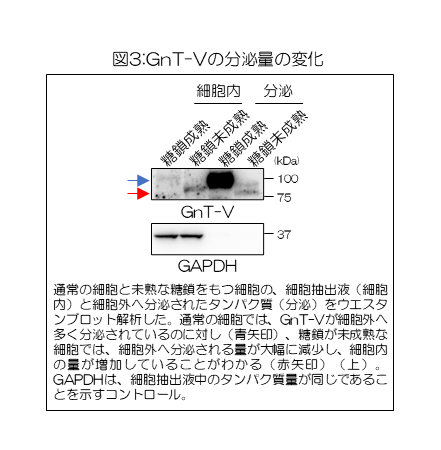
そこで、細胞外へのGnT-Vの分泌量を調べたところ、通常の細胞に比べ、糖鎖を未熟にした細胞では分泌量が大きく減少し、細胞内に存在するGnT-Vの量が増えていることがわかった(図3)。
これらの結果から、細胞が持つ糖鎖の形が未熟になると、GnT-Vの細胞外への分泌量が抑えられ、それにより細胞内のGnT-Vの量が増えて活性が高まることが判明した。
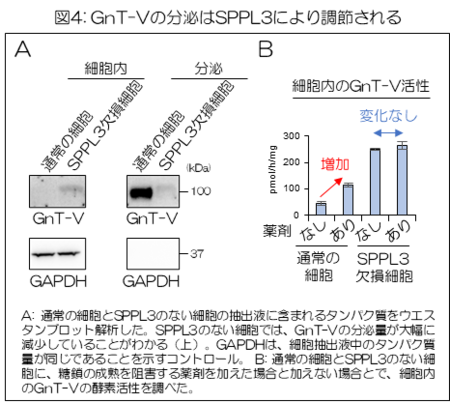
以前の研究で、GnT-VはSPPL3と呼ばれるタンパク質切断酵素によって切断されることで細胞外へ分泌されるメカニズムがわかっている。
実際にSPPL3を欠損させた細胞では、GnT-Vの分泌量が大幅に低下し、細胞内の量が増加していた(図4A)。そこで、通常の細胞と、SPPL3のない細胞を、それぞれN型糖鎖を未成熟にする薬剤で処理し、細胞内でのGnT-Vの活性の変化を調べた(図4B)。
通常の細胞では、これまで示したように、薬剤処理によってGnT-Vの分泌が抑えられ、その結果細胞内の量が増えて活性が増加する。一方、SPPL3のない細胞では、糖鎖を未成熟な形にする薬剤で処理をしても、細胞内のGnT-Vの活性は変化しなかった(図4B)。
つまり、通常の細胞で起こる、糖鎖の形に依存した細胞内のGnT-V活性の増加は、SPPL3を介したGnT-Vの分泌の低下が原因であることがわかった。
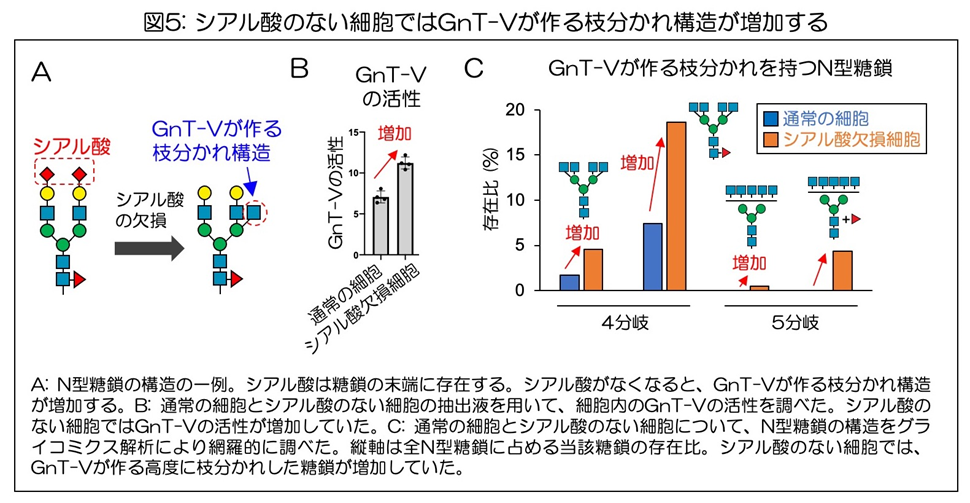
さらに、GnT-Vの分泌や細胞内の活性調節に必要な糖鎖の構造をより詳細に調べた。N型糖鎖は段階的に細胞内で成熟していき、多くのN型糖鎖では最終的に末端にシアル酸がつく(図5A)。
そこで、シアル酸を欠損させることで糖鎖の成熟の最終段階をなくした細胞を作り、細胞内のGnT-Vの活性を比較した。
その結果、シアル酸のない細胞では、これまで示した薬剤処理と同様に、GnT-Vの活性が増加することがわかった(図5B)。
この結果から、SPPL3によるGnT-Vの切断には、細胞が持つ糖鎖の末端のシアル酸の有無が重要であることがわかった。
最後に、シアル酸をなくして糖鎖の成熟を抑えた細胞で、GnT-Vが作るβ1,6分岐を持つ糖鎖が増加するかどうかを調べた。通常の細胞と、シアル酸のない細胞からN型糖鎖を回収し、グライコミクスと呼ばれる分析手法を用いて、糖鎖の形と量を網羅的に調べる解析を行った。
その結果、シアル酸のない細胞では、確かにGnT-Vが作るβ1,6分岐を持つ糖鎖の量が増加していることがわかった(図5C)。
同研究により、がんに関連する糖転移酵素GnT-VがSPPL3により分泌され、その分泌は細胞の糖鎖が未成熟になると抑えられることがわかった。これは、細胞が糖鎖合成酵素の切断制御によって糖鎖を作る活性を調節し、ひいては自身の持つ糖鎖の形を調節していることを示唆している。
GnT-Vの活性は、がんの発症や悪性化を促進する効果があるため、分泌を介してGnT-Vの活性を変えるこの仕組みは、がんの悪性化に関わる可能性がある。
一方、GnT-Vの切断には糖鎖末端のシアル酸の重要性が判明したが、糖鎖の形が変わるとなぜSPPL3によるGnT-Vの切断の度合いが変わるのかはわかっていない。
今後、SPPL3が糖鎖の形を見分けてGnT-Vの切断度合いを変える仕組みがわかれば、細胞の糖鎖の構造が変化する仕組みがさらに解明され、がんを始めとする糖鎖が関わる疾患の理解や治療薬開発に貢献すると期待される。
なお、同研究は、日本学術振興会の『科学研究費助成事業 基盤研究(B)』の支援のもとで行われた。


