ヒトの血管肉腫への応用にも期待
岐阜大学応用生物科学部の森崇教授、上野義仁教授らの研究グループは、犬血管肉腫 (HSA) のマウス腹腔内播種モデルにおいて、miR-214/5AE(核酸医薬)の腹腔内投与による治療効果を証明した。
HSAは、現在有効な治療法が存在せず、極めて予後が悪い。また、人でも同様の血管肉腫が発生するが希少疾患であるため研究が進んでおらず、今回の結果は人への応用も期待される。
また、抗腫瘍効果を示すmicroRNAの生体への投与は、細胞内への導入の困難さや、ヌクレアーゼによる分解が問題となっていた。これらの問題を改善した合成型miR-214であるmiR-214/5AEは、HSAのマウス腹腔内播種モデルにおいて、腫瘍細胞に対してアポトーシスおよび増殖抑制を誘導することを実証した。
加えて、miR-214/5AEの投与により、有害事象が発生しないことも明らかにした。これらの研究成果は、6日にVeterinary Research Communications誌のオンライン版で発表された。
現在、抗体医薬に次ぐ新たな創薬モダリティとして核酸医薬が注目されている。核酸医薬はオリゴヌクレオチドを基本骨格とする医薬品で、メッセンジャーRNA(mRNA)やDNAなどの遺伝子に直接作用することで薬効を発現する。核酸医薬は、その作用機序により様々な種類に分類されるが、その一つにマイクロRNA(miRNA)がある。miRNAは20~24塩基対から成る二本鎖RNAで、生体内で生成されmRNAに作用することでタンパク質の生成を調節する。
近年、miRNAの発現異常が細胞のがん化に関与していることが明らかになってきた。その生成の増加ががん化の原因となるmiRNAをoncomiR、生成の低下ががん化の原因となるmiRNAをantagomiRと呼んでいる。
また、がん化した細胞にmiRNA(antagomiR)を加えて細胞死を誘導(アポトーシス)すれば、がん細胞を死滅できることが明らかになっている。
従って、今日では、miRNA自身を抗がん剤として開発する試みが欧米の製薬企業、バイオベンチャー企業を中心に進んでいる。
だが、天然のRNAはリン酸基のもつマイナスチャージのため、同じく表面がマイナスチャージの細胞中へ入りにくいという物理的な問題に加えて、生体内に存在する核酸分解酵素(ヌクレアーゼ)により容易に分解されてしまう。RNAを医薬品として開発するには、これらの問題を解決する必要がある。
そこで、森氏らは、これまでにRNAの構成成分であるヌクレオシドに化学的に修飾を加えて構造を改変した人工ヌクレオシド(4′-アミノエチル修飾ヌクレオシド)(図1)を開発してきた。
また、この人工ヌクレオシドを導入したmiRNA(図2)がヌクレアーゼに対して抵抗性を示し、血清中で安定に存在し、標的遺伝子の発現を効果的に抑制することを明らかにしてきた。
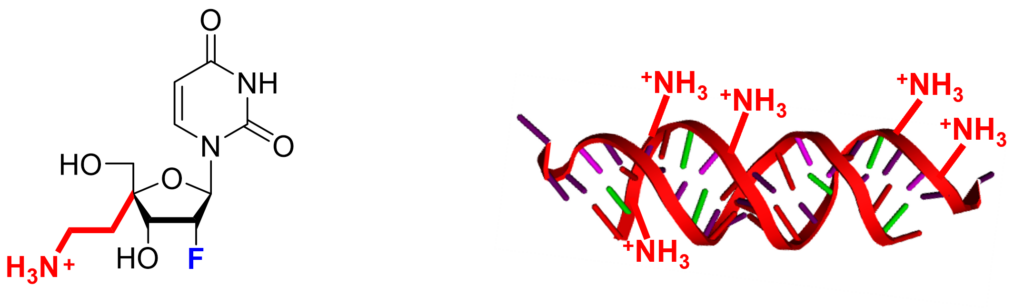
図2 miR-214/5AEの構造(右)
一方、HSAは極めて予後不良で、新たな全身治療法の開発が求められている。森氏らは、microRNAを用いたHSAに対する新規治療法を開発するため、microRNA-214(miR-214)がHSA細胞株においてアポトーシスを誘導することを発見した。
だが、RNAそのままでは細胞への取り込みに問題があり、加えて生体内のヌクレアーゼによって分解されてしまうため、生体内への投与は不可能であった。
そこで、成熟型miR-214よりも高い細胞毒性とヌクレアーゼ耐性を示す合成型miR-214(miR-214/5AE)を開発した。
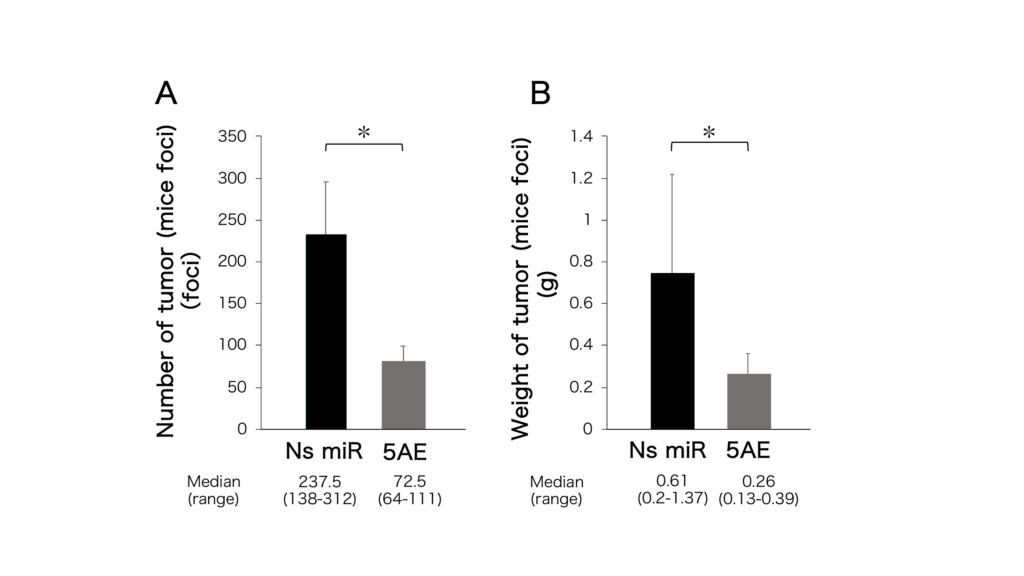
Ns miR:非特異的microRNA(コントロール群)
5AE:miR-214/5AE投与群
同研究では、miR-214/5AEは、マウス腹腔内播種モデルに対して安全に生体内投与が可能であり、腫瘍細胞のアポトーシスおよび増殖抑制を誘導することを実証した(図3)。
今回は、腹腔内投与を行ったが、この投与方法はmiR-214/5AEを腫瘍細胞に直接曝できるので、より効率的に腫瘍に導入できる可能性がある。
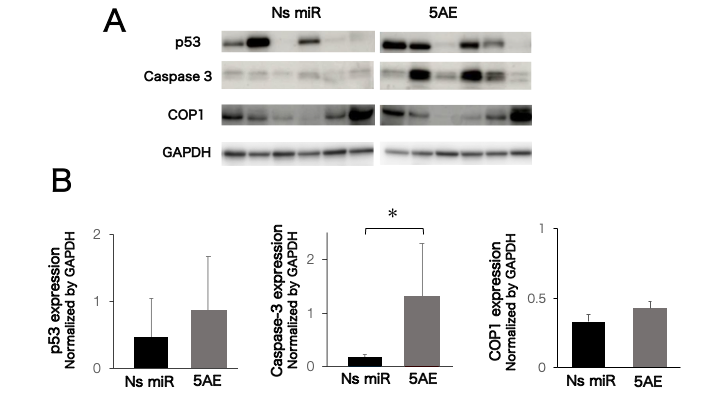
Ns miR:非特異的microRNA(コントロール群)
5AE:miR-214/5AE投与群
miR-214/5AE投与後のcreaved caspase-3,p53,COP1,Ki-67の発現を解析したところ,コントロール群と比較してp53とcreaved caspase-3の発現量が高い傾向にあり(図4)、また、Ki-67陽性細胞の割合が有意に低いことが確認された(図5)。
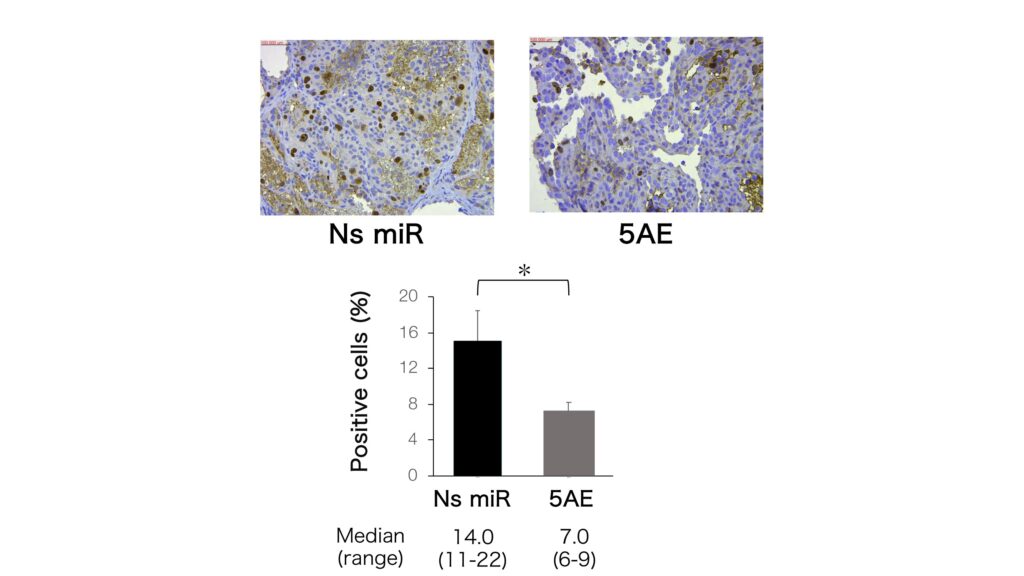
Ns miR:非特異的microRNA(コントロール群)
5AE:miR-214/5AE投与群
p53 経路の活性化が抗腫瘍作用に関わっていると考えられるが、その詳細なメカニズムはまだ解明されておらず、さらなる研究の必要がある。
miR-214/5AE投与による有害事象は、体重と血液検査で評価したが、コントロール群との間に差は見られなかった。今後、より長期の評価が必要であるが、同研究のプロトコールに従ったmiR-214/5AEの腹腔内投与は、重大な副作用がなく、忍容性が高い可能性が示唆された。
これらの結果は、HSA自然発症例や人血管肉腫に対するmiR-214/5AEを用いた新たな治療法開発の基礎となる可能性があると考えられる。
今回開発したmiR-214/5AEについては、現在有効な治療法の存在しない犬および人の血管肉腫に対する有効な治療法となり得る可能性が示されたため、今後自然発生症例や異なる投与経路の検討を進めていく。
また、今回の化学修飾法については、他のRNA創薬にも応用可能な技術であるため、その可能性は極めて広範囲に渡る。
生物の遺伝情報は,ゲノムDNAの中に保存されている。その情報はメッセンジャーRNAに託され,そこから数万種類ものタンパク質が合成される。これらのDNAやRNAは、従来「核酸」と呼ばれ、遺伝情報の運び屋として研究されてきまた。
だが、近年は、この核酸自身が新しいタイプの医薬品として活用されるようになり、低分子医薬や抗体医薬に続く「次世代型医薬品」として注目を集めている。
岐阜大学で生まれた核酸化学、糖鎖化学の技術やノウハウ、特許を活かした創薬開発を進めるベンチャー企業のGF・Milleでは、医薬品として優れた配列のRNAを選抜し、化学修飾を加えて合成することで、副作用の少ないRNA医薬の完成を目指して挑戦を続けている。
また、岐阜大学応用生物科学部附属動物病院では、多数の腫瘍性疾患の動物の治療を行なっているため、これらの症例を利用して新規オリゴRNA医薬品候補化合物の有効性を犬および猫における自然発症腫瘍にて確認することが可能である。
犬や猫の自然発症腫瘍は、モデル動物にはない多様性の存在や、人の自然発生腫瘍と生物学的動態が類似したものが多いなどの特徴があり、マウスと人の間を埋める存在として認識されつつある。
また、抗寄生虫薬のイベルメクチンやc-kitおよびPDGFRを標的とする分子標的薬であるmasitinibのように、先に動物薬として製剤化して、その安全性や効果を確認することで、巨額な開発費用が必要とされる人での製剤化のリスクを軽減が可能である。
森地らは、今後、今回の研究成果のこれらのメリットを生かして、RNA創薬による社会への貢献を進めていく意向を示している。


