岐阜薬科大学・岐阜大学大学院連合創薬医療情報研究科の檜井栄一教授らの研究グループは11日、金沢大学、東京大学との共同研究により、脳腫瘍の一種であるグリオブラストーマの「根治」を目指した新規の創薬ターゲットを発見したと発表した。
今回発見された創薬ターゲットは、がん幹細胞の機能を制御する“スイッチ”で、檜井らは、現在、がんの根治を指向した「がん幹細胞標的薬」の創製へとつなげるべく、SMURF2のThr249のリン酸化を調節してがん幹細胞の機能のON/OFFを切り替える新規がん治療薬の探索に取り組んでいる。
グリオブラストーマは、脳組織中のグリア細胞ががん化することで発症する疾患で、治療が非常に難しく、診断後の余命も極めて短い。その原因の1つとして「がん幹細胞」の存在が提唱されている。
がん幹細胞は「がん細胞を生み出す能力」と「治療抵抗性」を併せ持つのが大きな特徴で、がんの「根治」を目指すためには、がん幹細胞の制圧が重要とされている。
だが、「がん幹細胞の機能はどのように制御されているのか?」、「がん幹細胞を制圧するためには、どの因子を治療標的にすべきなのか?」については、不明な点が数多く残されている。
そこで、檜井氏らの研究グループは、がん幹細胞に発現するSMAD specific E3 ubiquitin protein ligase 2(SMURF2) というタンパク質が、がん幹細胞の機能をコントロールしていることを発見した。さらに、SMURF2の機能を調節する“スイッチ”を切り替えれば、グリオブラストーマの進行が制御されることを見出した。
同研究成果はSMURF2がグリオブラストーマ治療に対する有望な治療標的となりうることを明らかにしたもので、様々ながんの「根治」を目指した「がん幹細胞標的薬」の創製への応用が期待される。
これらの研究成果は,英国学術雑誌『Communications Biology』に掲載された。
檜井氏らの研究の詳細は、次の通り。
【研究の背景】
グリオーマは脳に存在するグリア細胞が腫瘍化した病気であり、悪性度によって大きく4つのグレードに分類される。このうち、グリオブラストーマは悪性度および発症頻度が最も高く、急速に悪化する頭痛や認知症、運動麻痺などの症状を特徴とする。
標準的な治療法として、まず手術による腫瘍組織の摘出が行われるが、グリオブラストーマは脳組織に染み込むように広がっていくため、完全除去ができない。
また、手術後に抗がん剤や放射線による治療を行ったとしても5年生存率は10%程度で、ここ数十年の間で治療成績に大きな改善は見られていない。
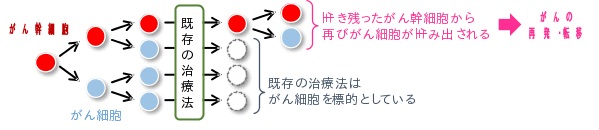
最近の研究から、治療後にもがん幹細胞が体内に残っていることが、グリオブラストーマの治療を困難にさせる原因の1つとして知られつつある。がん幹細胞は「がんの親玉」とも言われるように、自分自身のみならず、がん細胞をも生み出す(がん幹細胞性)。
また、がん幹細胞は、既存の抗がん剤や放射線に対して治療抵抗性を有する。従って、がん幹細胞の制圧により、グリオブラストーマの治療成績を大きく向上させ、根治が期待される (図1)。だが、がん幹細胞の機能がどのようにして制御されているのか、その詳細なメカニズムの全容は未だ明らかになっていない。
檜井氏らの研究グループは、これまでにがん幹細胞のCDK8タンパク質の働きを阻害することでがんの進展抑制に成功しており、がん幹細胞を標的とする治療法の有効性を示している(Fukasawa K. et al., Oncogene (2021))。
また、同グループは、骨や脂肪を生み出す間葉系幹細胞の機能調節におけるSMURF2タンパク質の重要性や、さらにSMURF2の働きを制御する “スイッチ”(=Thr249のリン酸化)を発見している(Iezaki T. et al., Development (2018))。
【研究成果の概要】
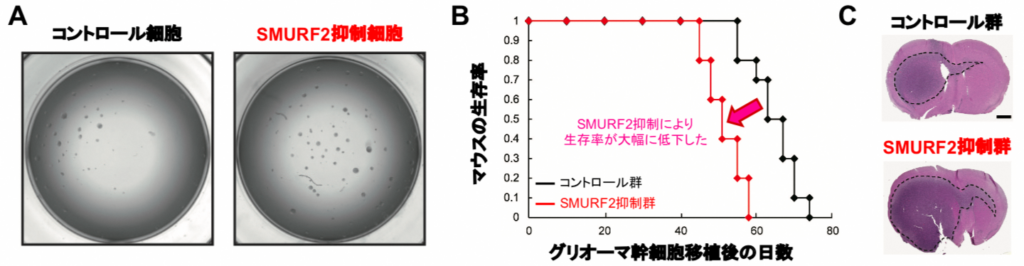
今回、檜井氏らは、まず、SMURF2がグリオーマ幹細胞の機能にどのような影響を与えているのか調べるため、患者由来のグリオーマ幹細胞を用いた実験を行った。その結果、SMURF2の働きを抑える(=SMURF2抑制細胞を作製する)ことによって、がん幹細胞の機能の指標であるスフィア形成能が増強した(図2A)。
また、SMURF2抑制細胞をマウスに移植したところ、生存期間の大幅な短縮(図2B)と、腫瘍サイズの増大(図2C)が認められた。以上より、がん幹細胞の腫瘍形成能には、SMURF2が非常に重要であることが示された。
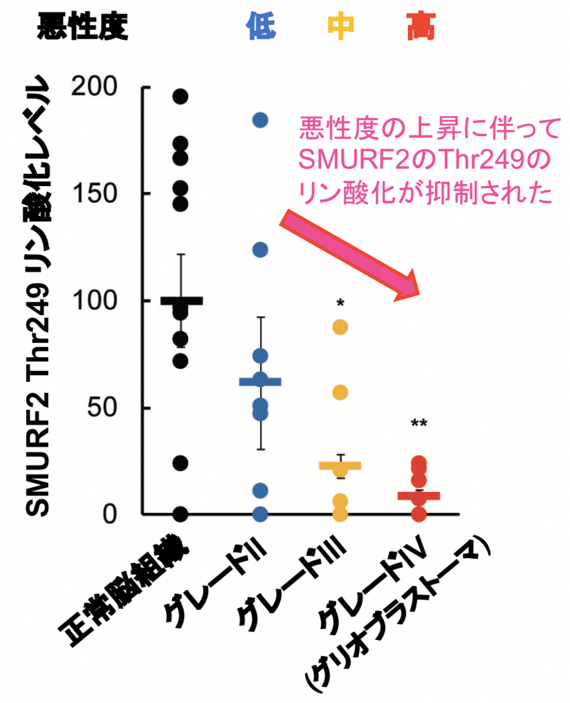
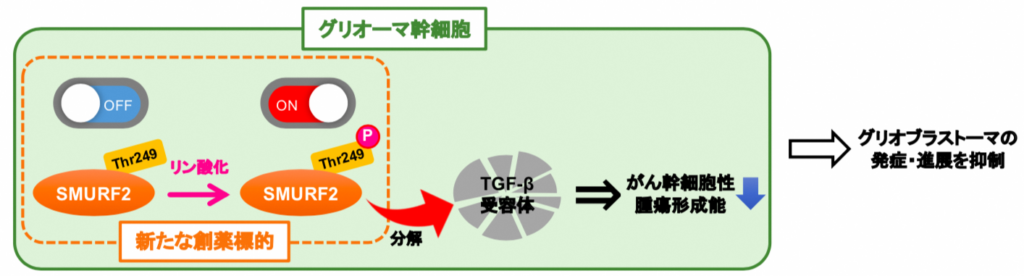
次に、SMURF2の活性がグリオーマの悪性度と関連しているかについて検討した。グリオーマ患者から摘出した腫瘍組織を調べたところ、グリオブラストーマを含む悪性度の高い腫瘍組織では、SMURF2のThr249のリン酸化が著しく抑制されていた(図3)。すなわち、グリオブラストーマではSMURF2の活性化が抑制されていることが分かった。
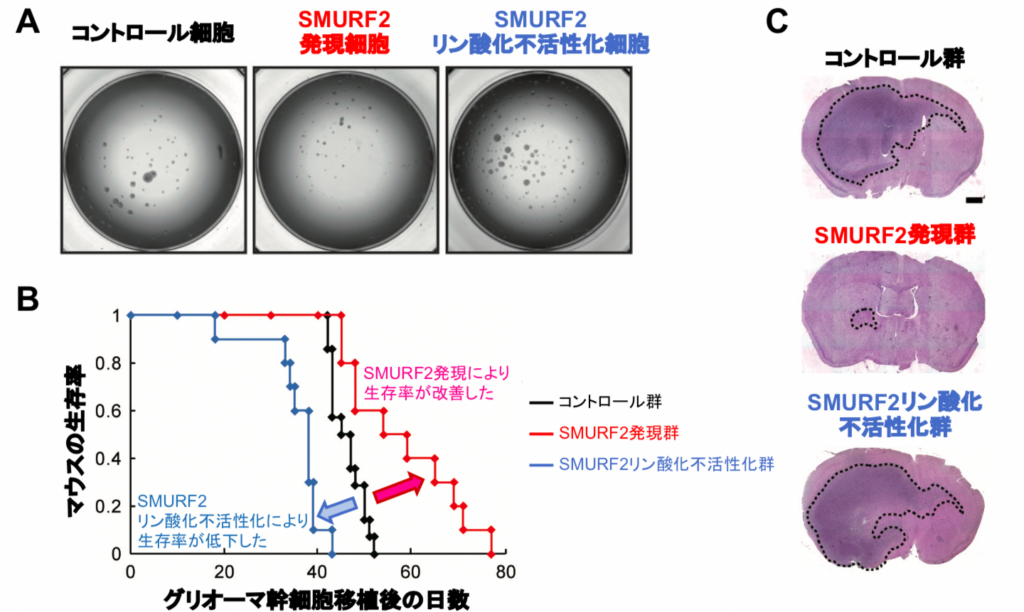
そこで、 SMURF2 発現細胞及び SMURF2 の Thr249 がリン酸化されないグリオーマ幹細胞(= SMURF2 リン酸化不活性化細胞)をそれぞれ作製して観察したところ、 SMURF2 発現細胞ではスフィア形成能が低下するのに対し、 SMURF2リン酸化不活性化細胞では逆に増強していた(図4A)。
さらに、各細胞をマウスに移植したところ、 SMURF2 発現細胞では生存期間の延長と腫瘍サイズの減少が見られたのに対し、 SMURF2 リン酸化不活性化細胞では生存期間の短縮と腫瘍サイズの増大が認められた(図4B,C)。
以上の結果を総合すると、SMURF2 によるがん幹細胞の機能調節には、Thr249のリン酸化状態が重要であることが明らかになった。
最後に、SMURF2はどのようなメカニズムでグリオーマ幹細胞の機能を調節しているのかを検討した。その結果、がん幹細胞の機能調節に重要なTGF-β受容体の分解をSMURF2が促進させていることがわかった。
つまり、SMURF2はTGF-β受容体の分解を介してグリオーマ幹細胞の機能を抑制していることが示唆された(図5)。
【研究成果の意義・今後の展開】
研究グループは、SMURF2がグリオブラストーマ幹細胞の制御因子であることを発見した。また、そのメカニズムとしてThr249のリン酸化の重要性や、活性化したSMURF2がTGF-β受容体の分解を介して、グリオーマ幹細胞の機能を調節していることを世界で初めて明らかにした。
同研究によって「がん幹細胞の機能を制御するメカニズム」の一端が明らかになったとともに、「がんの根治には、がん幹細胞の制圧が重要である」という説に新しいエビデンスを付与した。
現在、がんの根治を指向した「がん幹細胞標的薬」の創製へとつなげるべく、SMURF2のThr249のリン酸化を調節する(=“スイッチ”のON/OFFを切り替える)できる薬剤の探索に取り組んでいる。
さらに、本研究成果はグリオブラストーマに限らず、がん幹細胞の存在が明らかとなっている種々の難治性がんにも当てはまる可能性があるため、アンメット・メディカル・ニーズ の解消への貢献が期待される。


