
川崎市産業振興財団ナノ医療イノベーションセンター(センター長:片岡一則氏、略称:iCONM)は27日、東京大学大学院工学系研究科バイオエンジニアリング専攻との共同研究により、血液脳関門(BBB)を突破し、臓器選択的に脳組織へ薬物を送達するシステムを開発したと発表した。
同システムは、脳にのみ選択的かつ効果的に薬剤を届けることを可能とするため、末梢組織での副作用を極限に抑えた中枢作用薬創出への寄与が期待される。
脳組織とそこに酸素や栄養を送る脳内微小血管との間には血液脳関門 (BBB) と呼ばれるバリアーがあり、外因性物質が脳組織へむやみに入り込むことを防いでいる。BBBの存在は、中枢神経領域の創薬において、しばしば障壁となるため、BBBを突破し薬剤を脳内に送達する技術の開発に期待が集まっている。
最近の例では、BBB関連のタンパク質に結合するリガンドを外殻に持つナノマシンに治療薬を搭載することで、脳への治療薬送達に成功している。
だが、これらの標的タンパク質は末梢臓器でも顕著に発現している場合があり、これまでの戦略では、臓器選択的に脳への薬剤送達に限界が生じるという懸念がある。
今回の発表ではBBBの高い非透過性に着目するとともに、BBBを構成する脳血管内皮表面に発現するPECAM1(血小板内皮細胞接着分子)に特異的なモノクローナル抗体(抗PECAM1抗体)を用いて一定量のリガンド(ビオチン)を意図的に保持するという新しい戦略を考案した。
脳血管内皮細胞のエンドサイトーシス率は末梢の内皮細胞に比べて低いため、結果として、ビオチンと高い親和性があるアビジンを結合させたナノミセルを、脳組織選択的に集積させることに成功した。
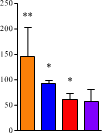
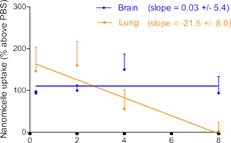
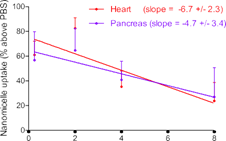
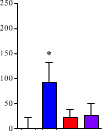
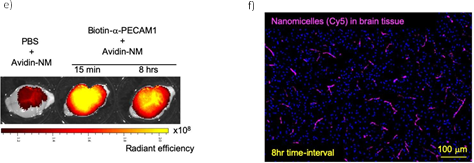
(青)、心臓(赤)、膵臓(紫)へのナノミセルの取り込みが観察された(a)。インターバルを長くとるに従って末梢臓器のナノミセルは減少したが、脳内では保持された(b,c)。8 時間のインターバルをとると、脳だけに選択的にナノミセルを留めることができた(d)。ナノミセルの脳内への蓄積は、生体から取り出したばかりの脳(e)および固定化された脳組織(f)で可視化できる。
ビオチンを結合させた抗PECAM1抗体(biotin-α-PECAM1)をマウスの尾静脈から注射し、予め定められた時間(15分、2時間、4時間、8時間で評価)経過後に、ビオチンと親和性の高いアビジンを結合させたナノミセル (avidin-NM)を同様に静脈注射。実験開始16時間後に麻酔をかけ、リン酸緩衝液で灌流したのちに肺、脳、心臓、膵臓を摘出。それぞれの臓器にナノミセルがどれだけ取り込まれたかを評価すると図1に示す結果となった。
この2段階によるターゲティング戦略は、脳内に効率よく薬剤を送達するとともに、末梢への蓄積を防ぐ方策となり、結果的にスマートナノマシンを用いた治療法の臨床的意義を高めると考えられる。
これらの知見による考察は次の通り。
脳血管内皮細胞のエンドサイトーシス率が低いことを利用して、ビオチンを結合させた抗PECAM1 抗体(biotin-α-PECAM1)を用いて血管内皮細胞上にビオチンを保持し、ビオチンと強い親和性を持つアビジン結合型ナノミセル(avidin-NM)を集積させるという仮説を検証した。
マウスにBiotin-α-PECAM1を静脈投与後に avidin-NMを投与すると、biotin-α-PECAM1の用量依存的に脳内へのナノミセル取り込み量が増加し、250μg/mLでmaxとなった。
脳以外でも、肺、心臓、膵臓でナノミセルの取り込みが観察されたが、biotin-α-PECAM1投与と avidin-NM投与のインターバルを長くとれば、これら末梢臓器への取り込みを減らせることがわかった。その一方で、脳では、長いインターバルをとっても高い取り込み量を維持できることがわかった。
これら研究の詳細は、7 月23日付米国科学アカデミー紀要 (PNAS: Proceeding of the National Academy of Science, Impact factor: 9.350 in 2019) に掲載された。


