大日本住友製薬は16日、ポストラツーダとして開発中の期待の統合失調症治療剤(SEP-363856)のP2試験(SEP361-201試験)で好結果を得たと発表した。同試験は、統合失調症に対する有効性と安全性の検証を目的としたもので、米国子会社のサノビオンが実施している。なお、試験結果はNew England Journal of Medicine のオンライン版に掲載された。
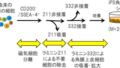
新世代の統合失調症治療剤を目指して実施されているSEP361-201試験では、SEP-363856の投与(50~75mg、1 回/日)により、主要評価項目である投与4週間後の陽性・陰性症状評価尺度(PANSS:Positive and Negative Syndrome Scale)合計スコアの変化量は、同剤投与群ではプラセボ投与群に対して統計学的に有意(本剤投与群:-17.2、プラセボ投与群:-9.7、p=0.001) かつ臨床的に意義のある改善を示し、主要評価項目を達成した。
また、臨床全般印象評価尺度- 重症度(CGI-S)の変化量でも、SEP-363856投与群は、プラセボ投与群に対して改善(p<0.001)を示し、全てのPANSSのサブスケール(陽性・陰性・総合精神病理)でも改善(p<0.02)が認められた。
同試験を通じて、SEP-363856投与群は、錐体外路症状、体重その他の代謝指標の影響においてプラセボ投与群と同等の安全性を示し、総じて良好な忍容性を示した。また、同剤を6ヵ月間継続投与したオープンラベル試験でも有効性が持続し、安全性と忍容性に新たな懸念は認められなかった。
統合失調症治療剤として開発中である同剤は、セロトニン5-HT1Aアゴニスト活性を持つ TAAR1(新規微量アミン関連受容体 1)アゴニストであり、既存の抗精神病薬の作用機序であるドパミンD2またはセロトニン5-HT2A受容体に結合しない。
現在、同剤の統合失調症を対象とした国際共同P3 試験(DIAMOND試験)を実施中で、その他の適応症についても検討している。FDAは、昨年5月に同剤を統合失調症の治療のためのBreakthrough Therapy に指定した。
イエール大学医学部臨床調査センターの Chair of Psychiatry and Co-Director で共著者のジョン・クリスタル医師は、「TAAR1を対象とした新たな作用機序の特定につながる大きな一歩はとても斬新である」と指摘。その上で、「過去 60 年間、その副作用にもかかわらず、ドパミン受容体に作用する抗精神病薬が統合失調症の標準治療であった。この試験結果が、深刻な精神疾患患者のための新たな治療法を支持することを願いたい」とコメントしている。
一方、サノビオン社Chief Scientific Officerのケネス・コブラン氏は、「New England Journal of Medicine に掲載された新たな知見は、本剤が統合失調症治療における最初の TAAR1アゴニストとなることを示唆している」と明言。さらに、「統合失調症治療に対するこの革新的なアプローチは、全世界で深刻な精神症状に苦しむ2300万人の患者にとって、全く新しい選択肢を提供する」と訴求した。
タイトルとURLをコピーしました