難治性乳がんに対する治療効果確認に成功
東京科学大学総合研究院 化学生命科学研究所の本田雄士助教らの研究チームと川崎市産業振興財団 ナノ医療イノベーションセンター(iCONM)は30日、ワイン成分であるポリフェノールを活用して、抗体を搭載したナノマシンを創成し、抗体をがん細胞内の標的箇所にピンポイントで送達する新しい治療法を開発したと発表した。
従来、抗体は細胞膜を通過し難い上に、仮に細胞に取り込まれたとしてもエンドソームという膜小胞器官から脱出できないため、細胞内では治療効果を発揮できないという課題があった。
同研究で創成したナノマシンによって、標的分子を認識し治療効果を示す抗体を細胞内に届けることで、これまで治療標的にするのが難しいとされた細胞質内の抗原にアプローチする新たながん治療法の誕生が期待される。
同研究では、ポリフェノールをステルス性の高いポリエチレングリコール(PEG)と結合させることで、抗体を搭載した直径約 30 nm のポリフェノールナノマシンを形成させ、血中安定性とがん組織への集積性を向上させた。
さらに、細胞内の酸性環境に応答して、抗体をエンドソームから効率的に放出させ細胞質内抗原に結合させることに成功した。このポリフェノールナノマシンは、難治性乳がんの同所移植モデルマウスにおいて強力な抗腫瘍効果を示し、無処置群と比較して腫瘍サイズを 20%にまで抑制した。同技術は、抗体医薬の適用範囲を細胞内部へと広げる革新的なプラットフォームとなる可能性がある。これらの研究成果は、6月4日付(米国東部時間)の「Journal of Controlled Release」誌に掲載された。
抗体医薬は、がんをはじめとするさまざまな疾患に対して高い治療効果を発揮するため、近年ますます注目を集めている。これまで多くの抗体は、細胞表面に存在する抗原を標的とすることで作用してきた。
たとえば、HER2 を標的とするトラスツズマブや、PD-L1を標的とするアベルマブといった抗体医薬が、がん治療薬として実用化されている。このように細胞表面に存在する抗原は世界中の製薬会社や研究機関によって分析し尽くされ、新しい標的抗原を探すのが困難になりつつある。
だが、がん細胞内には、ヒトテロメラーゼ逆転写酵素や p53、MUC1など、治療標的となり得る多くの有望な抗原の存在が明らかになっている。これら細胞質内抗原を標的とする抗体が開発できれば、治療の選択肢がさらに広がる。とはいえ、抗体は分子量が大きく、親水性が高く、全体として負の電荷を持っているため、細胞膜を通過することが難しく、細胞内への取り込み効率が極めて低いという課題がある。
また、仮に細胞に取り込まれたとしても、抗体はエンドソームという細胞内小器官に閉じ込められてしまい、標的の抗原が存在する細胞質へ到達できないという問題があった。こうした問題に対して従来は、正電荷を持つカチオン性高分子やペプチド、リポソームなどの物質を用いてエンドソームからの脱出を促進する方法が試みられてきた。
だが、これらの物質にはカチオン性由来の細胞毒性を引き起こしたり、血中での安定性に欠けたりといった懸念があった。
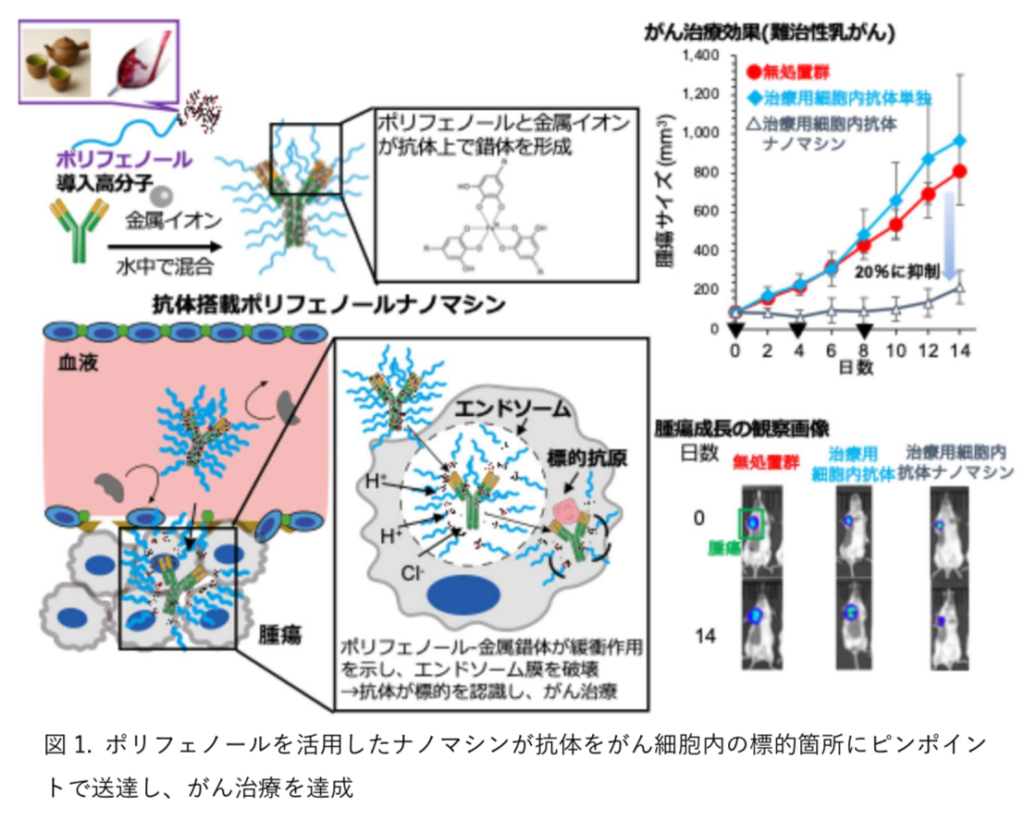
同研究では、細胞内抗体での治療を実現するため、金属-ポリフェノール錯体(MPN)に基づく新たなポリフェノールナノマシンを開発した。MPN は、ワインやお茶などに含まれるポリフェノールと金属イオンとの間の配位結合によって形成される構造で、今回はポリフェノールの一種であるタンニン酸(TA)と三価鉄イオン(Fe³⁺)を用い、抗体を効率的に搭載するポリフェノールナノマシンを構築した(図 1)。
その際、本田氏らは、TAをステルス性の高いポリエチレングリコール(PEG)と結合させたポリフェノール導入高分子を合成。PEGがナノ粒子表面を被覆する“シェル”構造を作ることで、血中での非特異的なタンパク質との相互作用を抑え、異物としても認識されず、体内での安定性と腫瘍組織への集積性を向上させた。
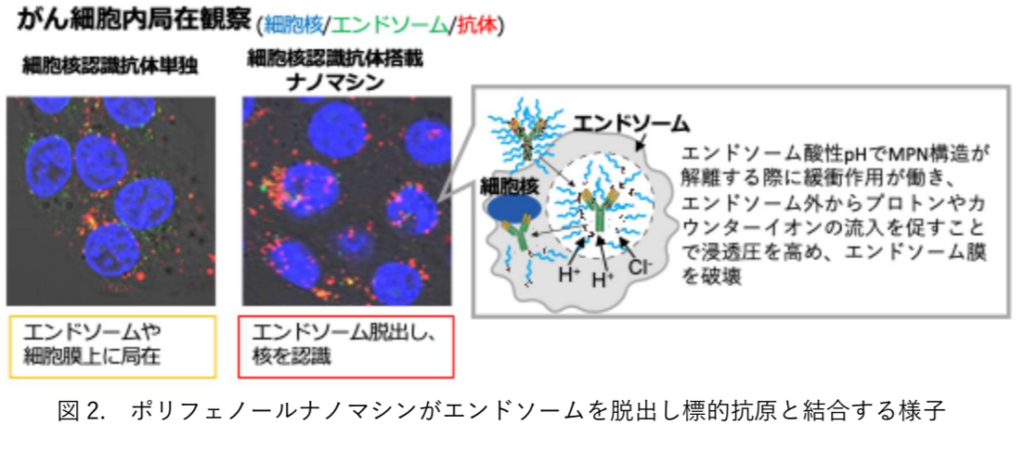
このポリフェノールナノマシンは、抗体と高分子、鉄イオンを単純に混合するだけで直径約30nmのコアシェル型 MPNナノ粒子を形成し、静脈注射による全身投与でも安定性を維持しながら、腫瘍組織に集積する。さらに、がん細胞内に取り込まれた後は、エンドソームに捉えられても、その酸性環境でMPN構造が解離する際に緩衝作用が働きプロトン(水素イオン)を大量に消費するため、エンドソーム内へプロトンやカウンターイオンの流入が起こって浸透圧が上昇し、エンドソーム膜は破壊されて抗体が細胞質へと放出される(図 2)。
この際、ポリフェノール導入高分子の電荷はほとんど中性であり、従来のエンドソーム脱出技術のようにカチオン性分子を使うことがないため、細胞毒性および血中での安定性などへの懸念がないと考えられる。 治療効果を見るため、がん細胞内で発現している抗原に結合する治療用細胞内抗体(αS100A4)をこのナノマシンに搭載し、従来の抗体医薬では治療が困難なトリプルネガティブ乳がん(TNBC)を乳腺に同所移植したモデルマウスに投与したところ、がん抑制タンパク質の活性化による治療効果の向上が確認され、無処置群およびナノマシンを用いない治療用細胞内抗体単独群と比較して、がんの大きさを 20%にまで抑えることに成功した(図 1)
同研究で開発されたポリフェノールナノマシンは、抗体医薬の適用範囲を細胞表面から細胞内部へと拡張する可能性を持つ画期的な技術である。特に、既存の治療法では標的にできなかった細胞質内抗原を狙った治療が可能となることで、難治性のがんに対しても新たな治療アプローチを提供することが期待される。
実際に、今回治療を行った乳がんは、従来の HER2 を標的とするトラスツズマブなどの抗体医薬では治療が困難なTNBCであることから、このナノマシンが難治性のがんに有効であると期待される。
また、同技術は従来のカチオン性物質を用いた方法とは異なり、毒性が低く、生体適合性の高い非カチオン性材料で構成されているため、安全性の面でも優れており、臨床応用においても大きな利点がある。加えて、抗体との複雑な化学修飾や遺伝子改変を必要とせず、「混ぜるだけ」で作製可能という製造面での簡便さも特筆すべきポイントであり、医薬品としての量産や実用化にも大きく貢献する技術だ。
今後は、同技術を応用して、がんだけでなく、細胞内で異常タンパク質が関与する神経変性疾患や自己免疫疾患など難治性疾患に対する治療法の開発にもつなげていく。
また、様々な種類の抗体との組み合わせや、標的抗原の選定によって、個別化医療(プレシジョンメディスン)に対応した治療法の開発も視野に入れている。さらに、このナノマシンは抗体だけでなく、他のタンパク質や核酸タンパク質複合体も搭載できるため、幅広い疾患への適応が期待でき、治療プラットフォームになる可能性を秘めている。臨床試験を見据えた研究では、毒性評価、製剤安定性の検証、製造プロセスの最適化などを進めていく予定である。


