微量な臨床検体からリン酸化シグナルを解析できる技術を開発

国立研究開発法人医薬基盤・健康・栄養研究所(大阪府)創薬デザイン研究センターの足立淳副センター長らのグループ(創薬標的プロテオミクスプロジェクト)は、最先端のプロテオーム解析技術を用いて治療標的やバイオマーカーを探索する研究を続け、進行胃がんや大腸がん肝転移の新たな治療法などにもつながるいくつかの成果を生み出している。
創薬標的プロテオミクスプロジェクトの目標は「シグナル創薬・治療法開発」と「バイオマーカー開発」の2つである。
「シグナル創薬・治療法開発」では、細胞の機能調節に関与する代表的シグナルであるタンパク質のリン酸化に着目し、特定の疾患や病態でどのタンパク質のどの部分のアミノ酸がリン酸化しているのかを質量分析計で定量的に計測することにより、新たな治療標的を発見することを目指している。
また、「バイオマーカー開発」では血液中の細胞外小胞(エクソソーム)に含まれるタンパク質を質量分析計で解析し、疾患特異的なバイオマーカーを発見、実用化することを目指し、これまでに、①大腸がん早期診断マーカーと期待されるタンパク質の同定、②一度に96検体からエクソソームを精製することができる自動精製技術開発、③血液を循環する由来組織別エクソソームマーカー候補を同定、④尿中エクソソームを用いて膀胱がんを診断する検査法開発、⑤表面構造に基づくエクソソームのサブクラス分離技術を開発――などの成果を生み出してきた。
リーダーを務める足立氏は「シグナル創薬・治療法開発でもバイオマーカー開発でも患者さんから採取した貴重な生体試料を用いるため、量が少ない検体で高感度に解析できる技術を開発することが重要になる」とポイントを示す。
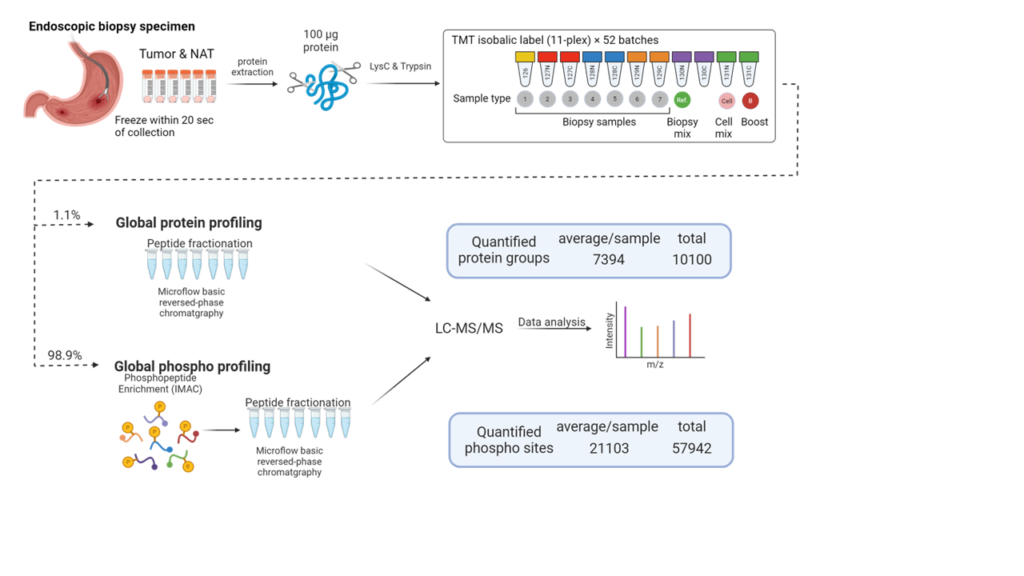
2024年10月、足立氏らのグループは国立がん研究センターなどとの共同研究で、胃がんの治療標的を同定したと発表した。足立氏らは採取してから20秒以内に凍結した未治療胃がん患者の内視鏡生検検体を用いて、リン酸化シグナル解析を実施した。
足立氏によると、リン酸化シグナル解析には一般的なタンパク質の解析に比べて数十倍の検体量が必要だという。生検の検体は小さいため、1個の検体から得られるタンパク質はおよそ100㎍しかない。
そこで、足立氏らは7個の検体にそれぞれ質量の異なる標識を付けた上で混合し、さらに胃がんの培養細胞なども加えて1つのバッチを構成し、バッチ全体の感度を高めてリン酸化シグナル解析を行うようにした。標識を付けたことにより、混合してもどの検体から出た結果であるかが分かる。他にも工夫を重ね、微量な検体から高感度にタンパク質の発現量とリン酸化シグナルを検出できる技術を確立し、1検体当たり平均7,400個のタンパク質と平均21,103個のリン酸化部位を定量することに成功した(図1、 Shoji et. al. Cell reports 2024から転載)。
リン酸化シグナル解析の結果、未治療の胃がん患者の検体は ①細胞周期を制御するキナーゼ群が活性化しているタイプ(全体の35%)、 ②上皮間葉転換(EMT)タイプ(同15%) ③酸化的リン酸化亢進タイプ(同50%)に分類できた。サブタイプ②のEMTタイプは転移しやすく、化学療法や免疫チェックポイント治療への耐性も報告されている。
足立氏らは次に、切除不能進行胃がん患者9人から、1次治療での化学療法後(2次治療前)、2次治療中、増悪時の3段階で内視鏡生検検体を採取し、リン酸化シグナル解析を行った。
その結果、1次治療後(2次治療前)、2次治療中、増悪時と治療が経過するほど、EMTタイプの割合が増加した。未治療患者で多かったサブタイプ ①、③の患者は、2 次治療中、増悪時には存在が認めらなかった。
足立氏は「メカニズムは明らかになっていないが、化学療法によってサブタイプが変化した、あるいは複数のサブタイプのがん細胞が混じっていたがEMTタイプのみが生き残って増殖した可能性が考えられる」と話す。
さらに、足立氏らはEMTタイプで活性化している受容体型チロシンキナーゼ「AXL」に着目し、胃がん培養細胞や胃がんモデルマウスを用いた実験で、AXL 阻害剤とパクリタキセルの併用療法が抗腫瘍効果を有することを確認した。
予後不良な大腸がん肝転移再発例の治療標的を発見
また、2024年12月に発表された最新の研究成果が、がん研究会有明病院などとの共同研究による大腸がん肝転移の新たな治療標的発見である。大腸がん肝転移症例に対しては、標準治療で腫瘍切除と術後補助化学療法が実施されるが、化学療法が奏功せずに再発することも多い。ただ、大腸がん肝転移は何度も繰り返し切除することが推奨される唯一のがん種である。
そこで、足立氏らは同一症例(患者)の化学療法前後の手術検体を用いてプロテオーム解析で比較する研究を行った。大腸がん肝転移再発例は、1次化学療法中に再発した症例群(During群)と1次化学療法後に再発した症例群(After群)に分けられるが、During群は極めて予後不良とされる。
足立氏らは2万個超のリン酸化定量データから各群の化学療法前後でのキナーゼ活性変動プロファイルを取得し、群間比較を行った。その結果、During群ではキナーゼの一種であるPAK1が活性化していることが分かった。
PAK1阻害剤はまだ承認された医薬品がないため、足立氏らは大規模な薬剤感受性データベースやリン酸化シグナルデータを用いて、PAK1活性化を抑制できる可能性のある薬剤を予測した(図2)。
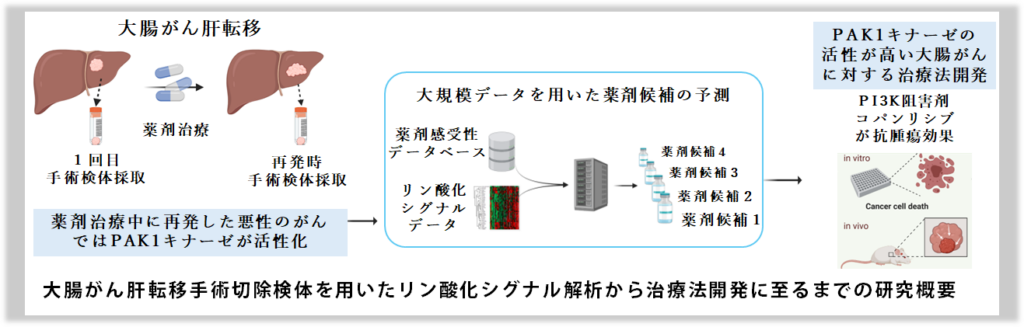
「35種の大腸がん培養細胞株でそれぞれどんなリン酸化シグナルが活性化しているかを解析し、公共の薬剤感受性データと照合して効く可能性のある薬剤を探していった。上位5剤にランキングされたのは、全て、PAK1の上流に位置するシグナルであるPI3Kの阻害剤だった」と足立氏。
そこで今度はPAK1が活性化している5種類の大腸がん細胞株を用いて複数のPI3K阻害薬をスクリーニングしたところ、リンパ腫治療薬としてFDA承認済みのCopanlisibががんの増殖を抑えることが分かった。PAK1高活性大腸がん培養細胞を移植した腫瘍マウスによる実験でも腫瘍抑制効果が示された。
足立氏は「新しい治療薬候補は示せたが、適応拡大などに結び付けるのはそれほど簡単ではないと実感している。だが、あきらめずに機会を伺い、臨床試験が行える状況になれば迅速に対応できるよう準備している」と明言。その上で、「一つでも多くの研究成果を臨床につなげるとともに、他の多くのがんに研究対象を広げていきたい」と展望を語った。


