ナノ医療イノベーションセンター(iCONM)および東京科学大学総合研究院化学生命科学研究所の本田雄士助教らの研究チームは、アデノ随伴ウイルスベクター(AAV)を搭載した新規スマートナノマシンを開発し、「中和抗体による遺伝子導入効率の低下」および「肝毒性」をマウスで克服することに世界で初めて成功した。
アデノ随伴ウイルスベクター(AAV)を搭載した新たなナノマシンは、ワインやお茶の成分であるタンニン酸にフェニルボロン酸からなる精密合成高分子を組み合わせたもの。
アデノ随伴ウイルスベクター(AAV)は、遺伝子治療用ベクターとして臨床応用されているAAVに対する中和抗体を有する患者では、十分な遺伝子導入効率が得られないことが知られており、投与可能な患者および複数回の投与が制限されている。
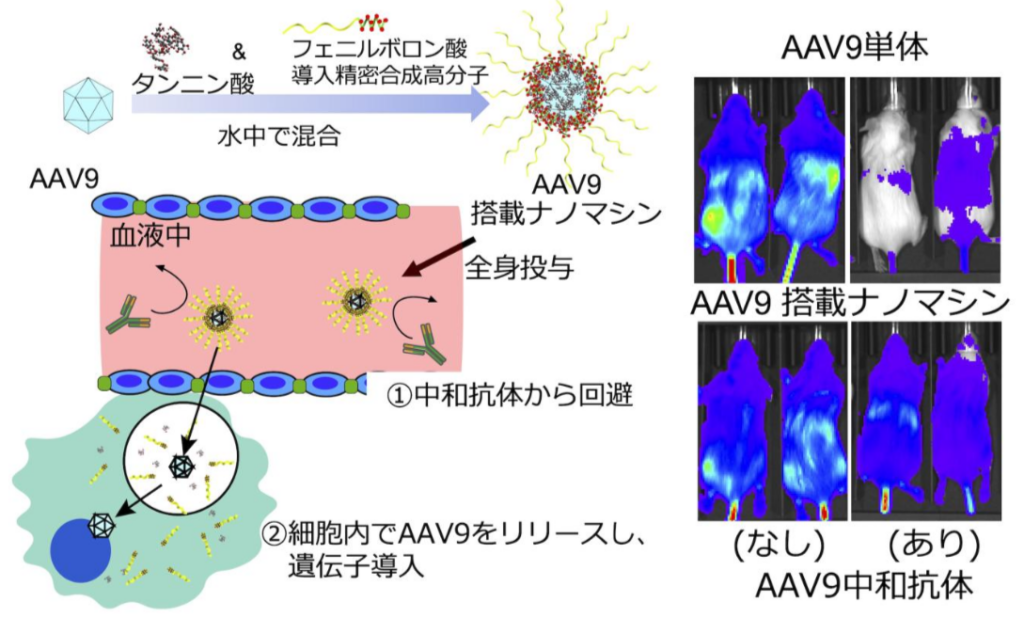
研究チームは、ワイン等に含まれる天然由来成分のタンニン酸が生体分子と簡単に接着する性質に着目して、フェニルボロン酸からなる精密合成高分子と組み合わせることで新規 AAV 搭載ナノマシンを開発した。
このAAV搭載ナノマシンは、AAV中和抗体存在下においても十分な遺伝子導入活性を示し、また、AAVの肝臓への集積を抑制することでAAV9による肝毒性マーカーの上昇を抑制できることも実証した。
一方、この AAV 搭載ナノマシンは中枢神経系への遺伝子導入に関して AAV 単体と同等の効率を示しており、十分な遺伝子治療効果が期待できる。
同研究成果は、中和抗体によって適応患者が制限されているウイルスベクター治療に対する新たな治療アプローチとして応用が期待される。これらの研究成果は、4日付の学術誌 ACS Nano でオンライン掲載された。
遺伝子治療は、疾病の治療を目的として遺伝子または遺伝子を導入した細胞を人の体内に投与する治療法だ。その中で、ウイルスベクターは、ウイルスが細胞に感染する機構を利用した遺伝子導入法として用いられている。遺伝子治療に用いられるアデノ随伴ウイルスベクター(AAV)は、様々な細胞種に遺伝子導入が可能であり、長期的に遺伝子発現が継続するため、脊髄性筋萎縮症、デュシェンヌ型筋ジストロフィー、血友病などの難治性疾患に対して臨床応用されている。
だが、「成人の大半がAAV 中和抗体を自然に持っている」、「一度AAVを投与すると中和抗体が産生されてしまう」ため、投与可能な患者および複数回の投与が制限されている。また、高容量の AAV 投与は肝臓・腎臓への毒性を示しており、臨床試験において死亡例が確認されている。
こうした治療の課題に対して、ウイルスベクターのカプシドをポリエチレングリコール(PEG)で修飾するアプローチや、リポソームなどの送達担体にAAVを内包する試みもあるが、ウイルスベクターの細胞内取り込みを阻害してしまい、遺伝子導入効率の低下を招く問題が存在する。
従って、血液中の中和抗体からAAVを回避し、肝臓への集積を抑えつつ、標的細胞への遺伝子導入を制御できるようなAAV送達システムが求められている。
中和抗体からAAVを回避するために、研究グループは、タンニン酸に精密合成高分子を組み合わせたAAV搭載ナノマシンを開発した。ワインや茶に多く含まれるポリフェノールの一種であるタンニン酸は、疎水性相互作用や水素結合を介してタンパク質やウイルスベクターなどの生体分子と相互作用し、複合体を形成する。
また、タンニン酸は天然由来成分であり、生分解性や生体適合性に優れている点から、医薬品の素材としても注目されている。このようなタンニン酸の優れた性質に着目し、本田氏らはタンニン酸とエステル形成するフェニルボロン酸導入精密合成高分子を組み合わせた生体分子送達ナノマシンについてこれまで報告している。
このナノマシンは水中で搭載したい分子とタンニン酸、精密合成高分子を混合するだけで簡単に形成する上に、細胞内の酸性pHで搭載分子を放出できるため、十分活性を示す。
研究グループは、このナノマシンにAAVを搭載させ、AAVの活性を損なうことなく、治療における課題(中和抗体、肝毒性)を解決することを図った。全身投与したAAVセロタイプ9型(AAV9)は、AAV中和抗体存在下のマウスにおいて、脳および肝臓などでの遺伝子導入効率は5-15%に低下した一方、AAV9をナノマシンに搭載することで全身投与した際の脳及び肝臓での遺伝子導入効率は約50-60%と、AAV9 単独投与よりも活性低下を顕著に抑えることに成功した。
さらに、このナノマシンは肝臓への影響を10%以下に抑えることや、高用量投与したAAV9の肝毒性の抑制にも成功しています。 この様に、遺伝子治療用ウイルスの課題を克服した上に、このナノマシンの脳における遺伝子導入はAAV9単体と同等であり、AAVの活性を下げる従来の送達担体の課題も解決するため、十分な遺伝子治療効果が期待できる。
さらに、マイクロバブル−集束超音波照射を組み合わせることで、脳への遺伝子導入選択性を6 倍にすることに成功し、医用デバイスの組み合わせによるさらなる高機能化の達成を明らかにした。本研究の新規性は、次の通り。
◆ ワインに含まれる”タンニン酸”と精密合成高分子を水溶液で混合するだけでアデノ随伴ウイルスベク
ター(AAV)を搭載したナノマシンを創成した。
◆ AAV 搭載ナノマシンはウイルスベクター遺伝子治療の課題となっている、中和抗体による不活性化、および肝臓への集積による肝毒性を克服した。
◆ ナノマシンは脳において AAV 単体と同等の遺伝子導入機能を示した。
◆ このナノマシンにマイクロバブル−集束超音波照射を組み合わせることで、AAV の脳への遺伝子導入効率を 6 倍にすることに成功した。
このナノマシンによって、遺伝子治療用ウイルスの臨床における課題である中和抗体による不活性化を抑制できるため、AAV による遺伝子治療を行える対象となる患者を増やすことができると考えられる。
また、このナノマシンは脳への遺伝子導入を維持しつつ、AAV の高用量投与による肝毒性を抑制できるため、さらなる投与量の増加も可能になり、治療効果向上が期待できる。
このAAV搭載ナノマシンは、水中で AAV、タンニン酸、精密高分子を混ぜるだけで形成するため、調製が簡便である上に、タンニン酸も高分子も生体適合性に優れており、臨床への応用にも適応がしやすい。
精密合成高分子のさらなる構造最適化によって、中和抗体回避能を上げることで、AAV9の複数回投与も可能になると考えられる。


