各疾患の非侵襲的早期診断や短時間での治療効果判定への応用に期待
東京大学大学院工学系研究科の近藤洋平氏(現東京科学大学生命理工学院助教らの研究グループは、オリゴペプチド型の超核偏極MRI分子プローブを開発し、生体内でその代謝反応を直接計測することに世界で初めて成功した。
アミノ酸が連なって構成されるペプチドやオリゴペプチドは、代謝・修飾、タンパク質との相互作用等を通じて生命現象に関与する重要な生体分子であり、その代謝や局在といった生体内ダイナミクス情報の取得が診断や治療技術を開発する上で近年注目を集めている。
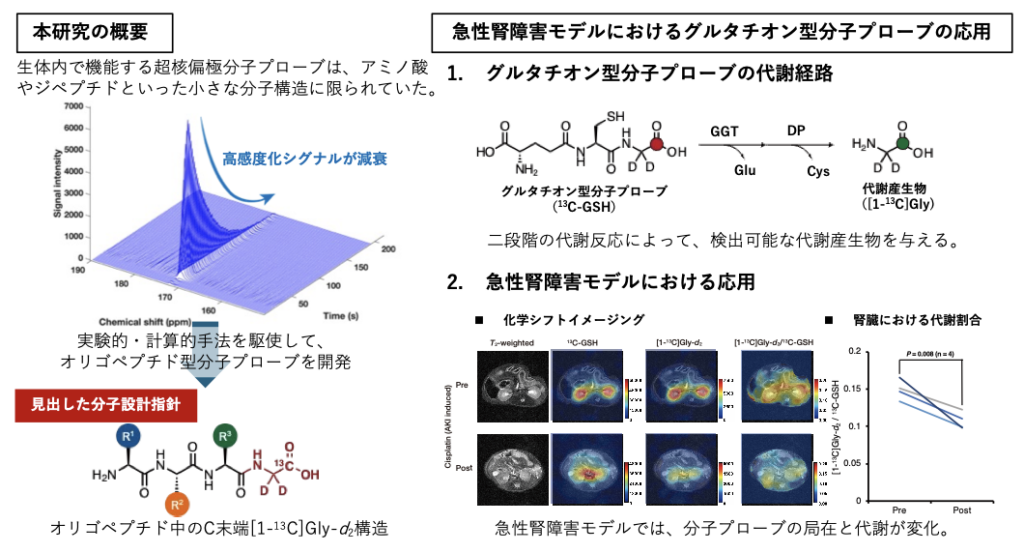
生体内でのダイナミクス情報を取得する手法として、核磁気共鳴法の検出感度を劇的に向上する量子センシング技術である超核偏極技術がある。超核偏極技術は、次世代の超高感度生体分子イメージングへの応用が期待されているが、超高感度化されたシグナルが時間とともに減衰し、高感度化信号の持続に影響する分子構造にも制約があるため、その適用範囲は分子量の小さなアミノ酸もしくはジペプチド等に限定されていた。
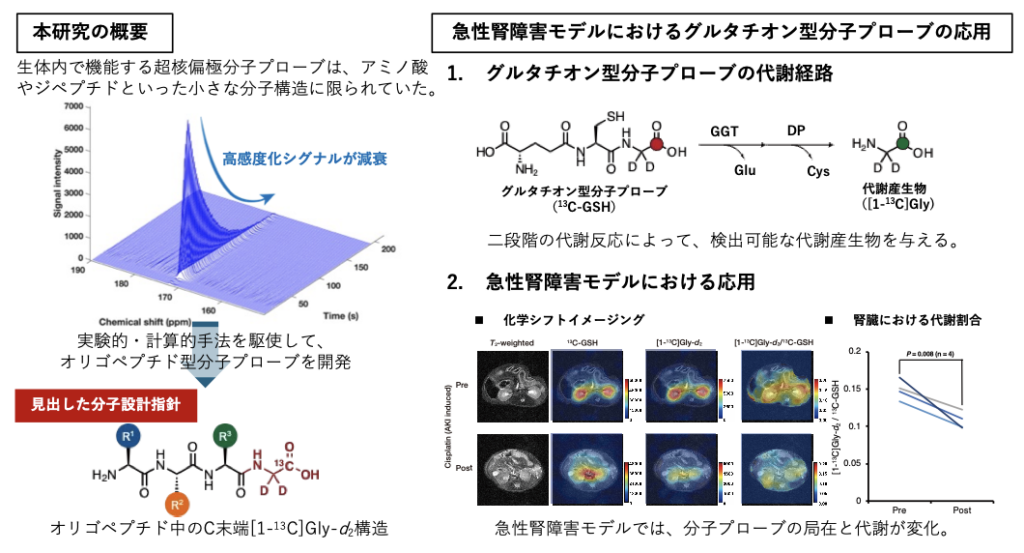
研究グループは、実験的・計算的手法を駆使して高感度化時間に影響を与える分子構造を精査することにより、生体内解析に使用可能なオリゴペプチド型の超核偏極MRI分子プローブの開発に成功した。開発した分子プローブの1つであるグルタチオン型分子プローブの感度を偏極装置 SpinAligner(QST 量子生命科学研究所に設置された国内1号機)を用いて一時的に10万倍以上に高め、これを尾静脈より速やかに投与することでマウスの急性腎障害に起因する生体内局在と代謝反応の変化をNMRやMRIにて直接計測することに成功した。
開発した分子プローブの鋳型となるオリゴペプチドは、もともと体内に存在する生体物質であり、さまざまな生命現象に関わっていることから、今後、関連する代謝反応や疾患の非侵襲的な画像診断法として応用されることが期待される。
同研究成果は本年10月16日(米国東部夏時間)に米国科学振興協会(AAAS)が出版する科学誌「Science Advances」のオンライン版に掲載された。
ペプチドは、アミノ酸が連なった生体分子であり、アミノ酸配列特異的な代謝・修飾やさまざまなタンパク質との相互作用等を通じて、生体内の生命現象に重要な役割を果たす。
また、ホルモンとしても機能することから、創薬の対象にもされている。このような背景から、ペプチドの生体内における代謝・局在といったダイナミクスに関する情報を取得することは近年注目を集めており、ペプチドの生体内解析は生命科学や医科学といった分野に大きく貢献すると考えられる。
生体内における分子の代謝・局在に関する情報を取得する手法として、量子センシング技術の1つである超核偏極技術がある。超核偏極技術は、プローブとして使用する生体分子の中での核スピンの占有数差を人工的に操作することによって、核磁気共鳴法の検出感度を数千〜数万倍向上させる量子センシング技術だ。
核磁気共鳴法では生体の構成成分として60%以上を占める水分子の水素核が主な検出ターゲットとされており、その他の分光学的手法と比べて検出感度の低さが問題とされている。
また、水分子以外の生体分子を生体内で直接検出することができれば、得られる情報の幅が広がり、生命科学や医科学のさらなる発展に貢献すると考えられる。
これまでに、超核偏極技術を用いて生体分子を超高感度化させて生体内でその代謝や局在を直接検出し、疾病の早期診断や治療効果を評価する試みが行われており、次世代の超高感度生体分子イメージングとして注目を集めている。
だが、超核偏極技術には高感度化した核磁気共鳴シグナルが指数関数的に減衰してしまうという問題がある。超核偏極技術のうち、最も広く用いられており、同研究でも用いられた動的核偏極法では、偏極装置と呼ばれる特殊な機器を用いて、分子プローブの核磁気共鳴シグナルの感度を向上させる。その高感度化プロセスは生体外で行われ、高感度化を実現した直後から分子プローブの高感度化シグナルは不可逆的に失われていく。
分子プローブの代謝・局在に関する情報を生体内において取得するためには、高感度化された分子プローブが生体に投与され、観測部位に運ばれてから代謝物が生じるまで、高感度化されたシグナルが維持される必要がある。
その高感度化時間の長さは、分子プローブの分子構造に大きく影響を受けるため、生体内で用いることができる分子プローブの構造やサイズには制約があった。具体的には、ペプチドについては、アミノ酸やジペプチドといった小さな分子構造しか、生体内で機能する超核偏極MRI分子プローブとして用いることができないと考えられていた。
このような背景のもと、研究グループは、実験的な精密分子設計や、量子化学計算等を駆使して高感度化時間に影響を与える分子構造を精査して、オリゴペプチド構造中でも高感度化信号を長く維持できる分子骨格を見出し、生体内解析に用いることができるオリゴペプチド型の超核偏極MRI分子プローブの開発に成功した(図1左)。
さらに、開発した分子プローブの1つであるグルタチオン型分子プローブを用いた生体内解析を実現し、マウスの急性腎障害モデルにおいて誘発される、近位尿細管に局在するグルタチオン代謝酵素の活性低下と、腎臓への灌流低下を可視化することに成功した(図1右)。
今回分子プローブとして開発されたグルタチオンはもともと体内に存在する生体物質であり、さまざまな生命現象に関わることが知られているため、次世代の超高感度生体分子イメージングとして非常に有用であると考えられる。
同研究成果は、今後、さまざまな生命現象の解明をはじめ、腎障害やその他のオリゴペプチド代謝関連疾患を非侵襲的に検出する診断技術としての臨床応用、また他の分子プローブを創製するための設計指針としても貢献していくことが期待される。


