岐阜大学大学院連合創薬医療情報研究科の本田諒准教授らのグループは、神経変性疾患の発症に関わるTDP-43およびアミロイドβ凝集体の超高感度検出技術を開発した。同術は、新たに発見された「Brij-58」という特異な性質をもつ界面活性剤を使用することにより、従来のシード増幅アッセイ法(SAA法)の検出感度を飛躍的に向上させたもの。
この技術により、最小5フェムトグラムという超微量の凝集体の検出が実現し、実際の患者の脳組織に蓄積した病的凝集体を検出することも可能となった。同技術は、将来的にはALSなどの神経変性疾患の早期診断や早期治療介入への応用が期待される。同成果は、10月8日にTranslational Neurodegeneration誌のオンライン版で発表された。
神経変性疾患は、アルツハイマー病や筋萎縮性側索硬化症(ALS)、前頭側頭型認知症(FTLD)などのように、脳や神経系が徐々に損傷されていく疾患である。これらの疾患に共通する特徴の一つが、異常なタンパク質の凝集体の蓄積だ。
TDP-43はALSとFTLD、アミロイドβはアルツハイマー病の原因物質として広く知られており、これらの異常凝集体が神経細胞の損傷を引き起こすことが示唆されている。このような背景から、病的な異常凝集体を高感度で検出する手法の開発が重要視されている。
シード増幅アッセイ(SAA)法は異常凝集体を試験管内で増幅することによって、これらを超高感度で検出する技術である。この技術は、プリオン病やパーキンソン病で蓄積する異常凝集体を検出することが可能であり応用研究が進んでいるが、TDP-43やアミロイドβの異常凝集体に関しては十分な検出精度がなかった。
これらの病的タンパク質の検出においては、反応基質となる正常型モノマーが非常に不安定ですぐに失活してしまうため、従来技術では異常凝集体の十分な増幅を起こすことができなかった。従来法での検出限界はおよそ15ピコグラムであり、この精度では病理学的に有意な微量の凝集体を捉えるには不十分であった。
そこで同研究では、新たなタンパク質の安定化技術を検索することによって、異常凝集体を効率よく試験管内で増幅し、検出する手法を検討した。
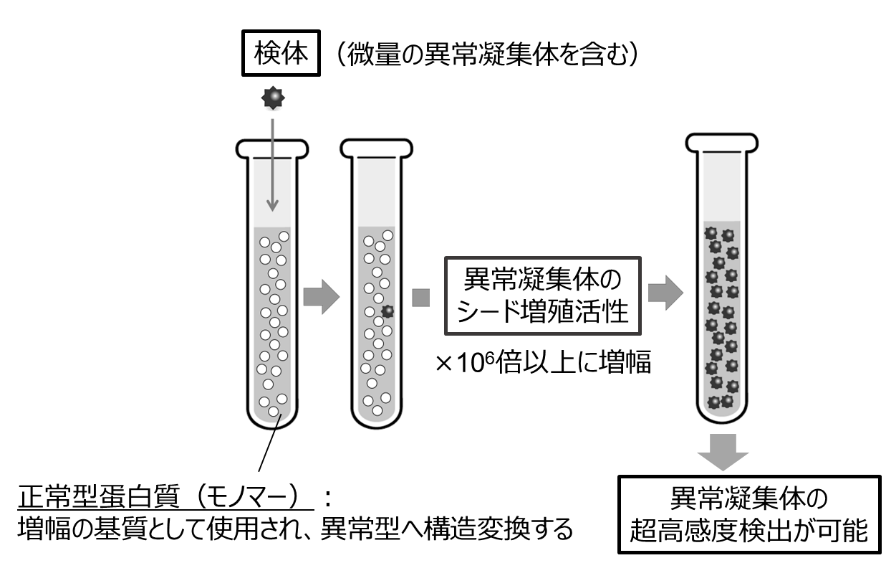
今回の研究の中心的成果の一つとして、新たな界面活性剤「Brij-58」の発見が挙げられる。Brij-58は、同研究で行った界面活性剤のスクリーニングから見出された。この界面活性剤は、TDP-43やアミロイドβのモノマーを安定化させつつ、凝集体のシード増幅を阻害しないという特異な性質を持つ。このため、病的凝集体の試験管内増幅と高感度検出に特に優れた効果を示す(図1)。

Brij-58を従来のSAA法に組み入れることで、TDP-43の病的凝集体をわずか5フェムトグラムという微量から検出することに成功した(図2)。これは従来の検出限界の数千倍に相当する。また、アミロイドβに対しても同様に高い検出感度が認められ、従来法の百倍以上の検出限界の向上が得られた。
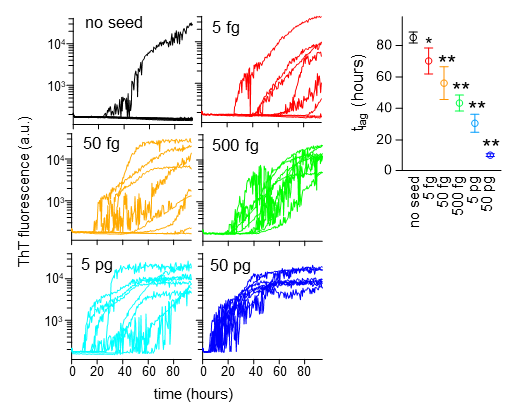
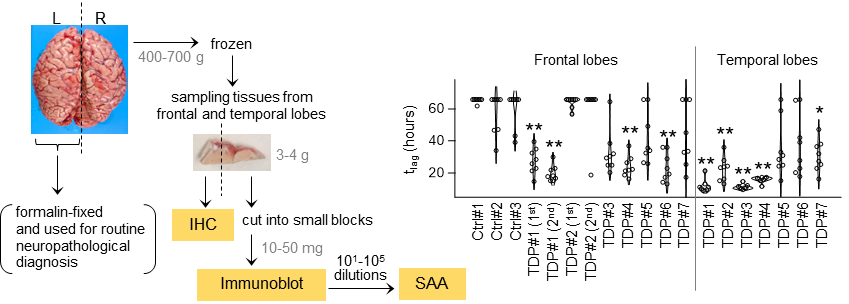
さらに、実際の患者から採取した脳組織を用いた検証実験でも、この新しい手法が高い精度で病的凝集体を検出できることが確認された。図3に示すように、ALSとFTLDの患者の脳組織からTDP-43凝集体を検出し、健常者との明確な差異を確認できた。この結果により、神経変性疾患の早期診断に向けた新たな検出技術として大きな可能性を示すことができた。
今回の研究成果は、神経変性疾患の早期診断や病態解明に向けた大きな一歩である。特に、同技術はTDP-43やアミロイドβの微量な凝集体を超高感度で検出できるため、疾患の発症前に異常なタンパク質の蓄積を検出し、早期治療介入に貢献できる可能性がある。
現在、今回開発された技術を活用し、臨床現場で採取した血液や脳脊髄液からTDP-43の病的凝集体を検出する研究を進めている。
また、同研究で開発したBrij-58を基盤とするSAA法は、他の病的凝集体の検出にも応用できると考えられる。例えば、病的凝集体のひとつであるFUSも、TDP-43やアミロイドβと同様に、従来のSAA法では検出が難しい性質を有している。同技術を広くさまざまな病的凝集体の検出に応用するために、さらなる感度向上に向けた技術改良も進めている。
なお、同研究は、せりか基金-宇宙兄弟ALSプロジェクト-、公益信託宮田幸比古記念ALS研究助成基金、科研費(JP23K06935、JP22K07359、JP22K06744)の支援を受けて行われた。オープンアクセス化に関して、オープンアクセス加速化事業(文部科学省補助金)(東海国立大学機構 岐阜大学)の支援を受けた。


