新たな仕組みによるがん治療開発に期待
龍谷大学先端理工学部の内田欣吾教授、産業技術総合研究所(産総研)の須丸公雄氏、山梨大学医学部桐戸敬太教授の研究グループは、光分子機械の一種であるジアリールエテンが、その光異性化に応じて細胞のDNAの塩基対間に挿入され、それに続く光照射で細胞死を導くことを見出した。
この細胞死が、カスパーゼ経路を経るアポトーシスであることは既に明らかにしていたが、今回、ヒトのがん細胞であるHeLa細胞をも殺傷することを見出した。
この細胞死のメカニズムは、DNAの塩基対間に挿入されたジアリールエテン分子が、その状態で光照射を受けると、光分子機械としてその場で開環・閉環反応を繰り返すことでDNAの二本鎖の両方を切断し、それにより細胞が死に至ることが分かった。こうしたメカニズムによる光細胞毒性の報告は他になく、新たな仕組みによるがん治療につながる可能性が示された。これらの研究成果は、アメリカ化学会の医化学ジャーナル『Journal of Medicinal Chemistry』誌に掲載された。
龍谷大学先端理工学部の内田研究室では、フォトクロミック化合物であるジアリールエテンの光応答挙動について長年研究してきた。ジアリールエテンは、無色の開環体に紫外光を照射すると着色した閉環体となる一方、これに可視光を照射すると元の無色の開環体に戻る。
同学、産総研および山梨大学の合同研究チームでは、光駆動型の分子機械としてのこうした特徴とそのバイオ応用の可能性に注目して、さまざまな検討を進めてきた。
2015年には、あるジアリールエテン誘導体の存在下、青色光(λ = 436 nm)を照射するとMDCK細胞(イヌ腎臓尿細管上皮細胞由来の細胞)が死滅し、これがカスパーゼの活性化によるアポトーシスであることを報告した(Chem. Commun., 2015, 51 (54), 10957-10960.)。
昨年には、12種類にも上るジアリールエテン誘導体の分子構造と細胞毒性の相関を調べることで、こうした光誘起細胞死を引き起こすためには、ジアリールエテン分子がDNAの塩基対間の空間に入れるサイズであることが必要条件であることを突き止めた(Org. Biomol. Chem., 2022, 20(15), 3211-3217.)。
そこでこれらの結果を踏まえ、ジアリールエテン分子が、どのように細胞死に関与するかを詳細に研究した。その結果、①チアゾール環をもつジアリールエテンの2つの異性体のうち、閉環体のみがDNAの塩基対間に挿入されて光吸収帯が長波長化し、波長436 nmの光照射によって開環化と閉環化の両方を引き起こされるようになる、②光駆動型の分子機械としてDNAの中で閉環・開環を繰り返すことで、まるで金属疲労のようにDNAの二本鎖の両方を同時に切断(double-strand break)するー実態を明らかにした。
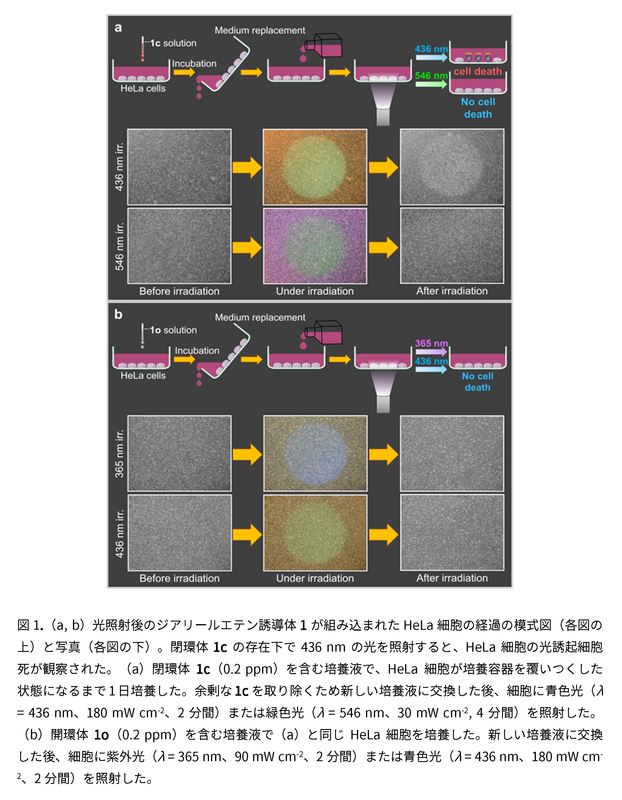
図1は、光で細胞死を起こす実験方法の模式図である。図1aでは、HeLa細胞の培養液にジアリールエテン誘導体1の閉環体1cをわずかに加えて培養し、青色光(436 nm)を照射すると、HeLa細胞は死滅した。 だが、開環化のみを引き起こす緑色光(546 nm)の照射では影響は見られなかった。なお、同様の実験を開環体1oの存在下で行ったが、紫外光(365 nm)や青色光(436 nm)の照射では細胞死は観察されず(図1b)、1oはDNAの塩基対間にほとんど挿入されないことが示唆された。
今回、光誘起細胞毒性の実験に用いられたジアリールエテン誘導体1, 2, 3の分子構造と光毒性を発現する最低濃度の関係を図2に示した。全ての開環体に光毒性はなく、Nを含むチアゾール環を2つもつ1cが最も強い光毒性を示し、チアゾール環を1つもつ2cはそれより弱い光毒性を、チアゾール環をもたない3cは光毒性が見られなかった。
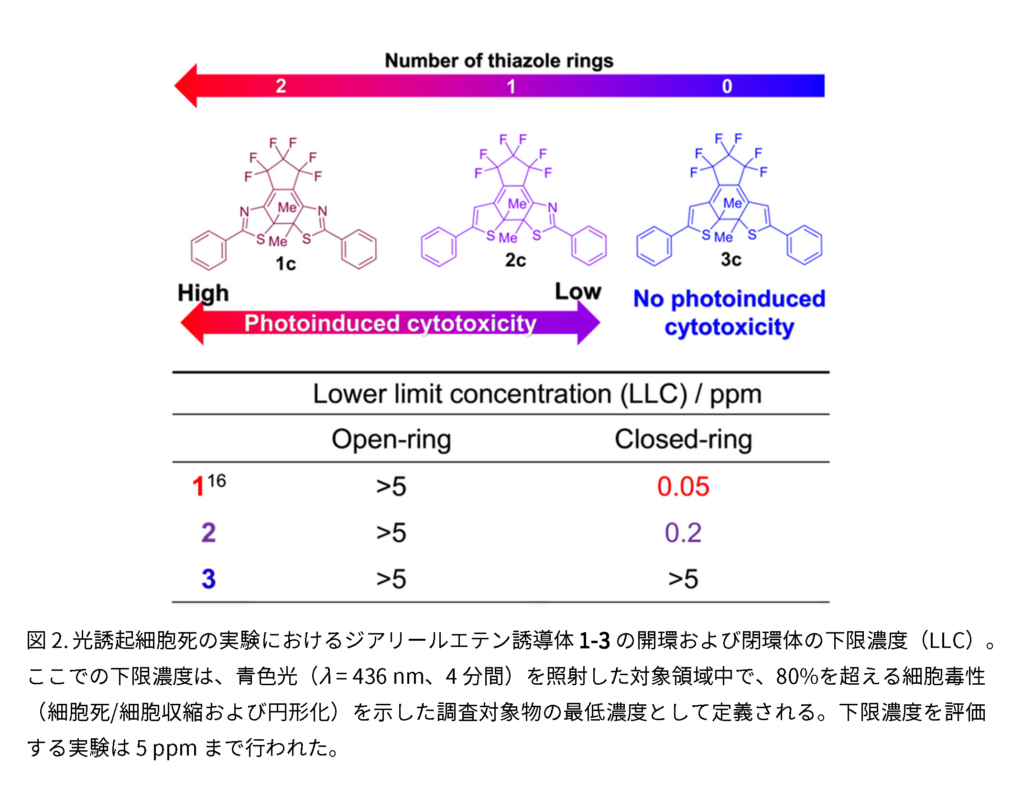
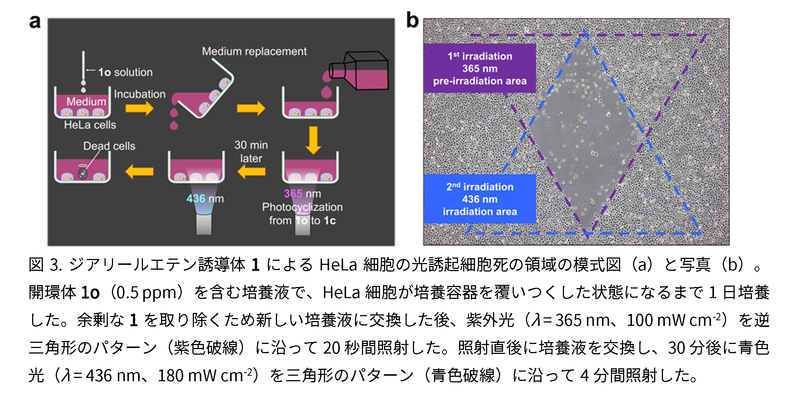
図3では、DNAへの挿入と繰り返し異性化が、それぞれ異なる波長の光によって制御され、両者が揃った場合にのみ細胞死が引き起こされることを明確に示すデモンストレーション実験の結果を示す。最初に開環体1oを加えてHeLa細胞を培養後、培養液を交換して余剰な1oを取り除き(図3a)、次に逆三角形の紫のライン内に紫外光(365 nm)を照射すると、細胞内の1oが1cに変換されます。続いて青色の三角形の部分に青色光(436 nm)を照射すると、2つの三角形が重なったダイヤ形の部分だけに細胞死が確認された(図3b)。
光線力学療法をはじめ、光を用いた現在の抗がん治療では、光照射により活性酸素種を生み出すか、光を熱に変えて患部を加熱するものが一般的で、このような光で動く分子はさみでDNAを切断するような例は知られていない。実用化するにはまだ、多くの課題が残されているが、新たな抗がん剤開発への一歩となりえる知見と考えられる。
なお、同研究は、JSPS科研費 挑戦的研究(開拓)「細胞内動態と細胞死を独立制御する光制御分子機械系の創生」JP22K18443の助成により行われた。