糖鎖精製の仕組み解明や糖尿病病態解明への応用に期待
岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦教授らの国際共同研究チームは19日、糖尿病にも関わる糖鎖合成酵素GnT-IVaの新しい反応機構を発見したと発表した。
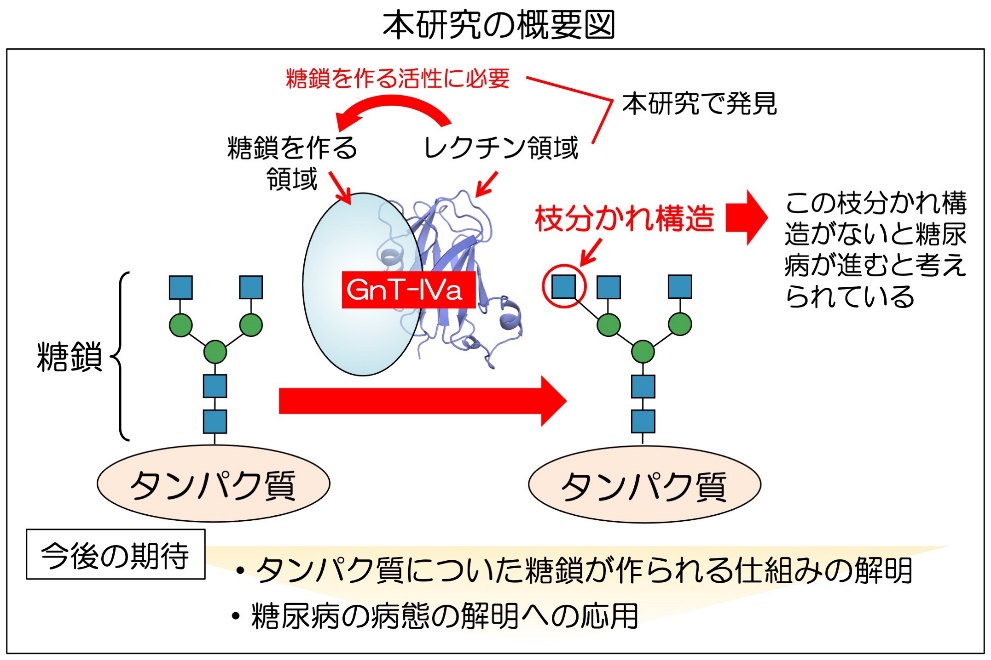
GnT-IVaは、タンパク質の上の糖鎖に枝分かれ構造を作る酵素で、糖鎖を作るための領域の他に、これまで知れている糖鎖合成酵素には見られない糖鎖と結合する領域(レクチン)があることを発見した。
さらに、その領域の立体構造の解明によって、レクチンが酵素活性に不可欠であり、特定の糖鎖との結合により効率的な糖鎖合成を進めていることを明らかにした。
同研究成果は、タンパク質の上に複雑な糖鎖が作られる仕組みの解明に重要な基礎的知見を与えるとともに、糖尿病の病態解明や治療法開発への寄与が期待される。
同研究は、岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦教授、大阪大学微生物病研究所の長江雅倫助教、東北医科薬科大学、産業技術総合研究所、University of Mississippiらのグループにより実施されたもの。これらの研究成果は、19日にNature 姉妹誌Communications Biology誌のオンライン版で発表された。
糖鎖とは、グルコースなどの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、多くはタンパク質や脂質などに結合した状態で存在している。
動物では、体内の半数以上のタンパク質に糖鎖がついている。タンパク質についている糖鎖には様々な形のものがあり、タンパク質ごとに形が異なり、同じタンパク質でも健康な時と疾患時では糖鎖の形が変化することなどが知られている。
こうした疾患特異的な糖鎖の変化は、実際に医療の現場でがんの診断などに使われている。また、特定の糖鎖が、がん、アルツハイマー病、糖尿病など様々な疾患において重要な役割を果たしているため、糖鎖を標的とした新たな治療薬の開発が期待されている。
タンパク質につく糖鎖は、細胞の中で糖転移酵素(糖鎖合成酵素)と呼ばれる酵素の働きによって作られる。180種類ほど存在しているヒトの糖転移酵素の一つとして知られるGnT-IVa3は、細胞の中で、タンパク質についたN型糖鎖と呼ばれる糖鎖に作用し、糖鎖の枝分かれ構造を形成する(図1)。
このGnT-IVaが作るβ1,4分岐と呼ばれる枝分かれ構造は、以前の研究で糖尿病の発症・進行と深い関係があることがわかっている。 GnT-IVaは、血糖調節に重要な臓器である膵臓に多く存在し、GnT-IVaを欠損させたマウスは高血糖やインスリン分泌不全などの糖尿病様の症状を示す。
また、ヒトの膵臓においても、糖尿病に罹患するとGnT-IVaの発現が低下する実態などから、GnT-IVaの活性向上が糖尿病治療戦略の一つと考えられている。
このように、GnT-IVaの生体での機能が明らかになりつつある一方で、GnT-IVa自身の立体構造や、GnT-IVaがどのような機構でタンパク質の上の糖鎖を作るのかという仕組みの詳細についてはよく判っていなかった。こうした背景を踏まえて、木塚氏らは、GnT-IVaの立体構造に注目し、この仕組みの解明に取り組んだ。
研究では、まず、GnT-IVaのアミノ酸配列に着目。GnT-IVaは、一般的な糖転移酵素よりアミノ酸配列が長いため、他の糖転移酵素とは異なるドメイン(領域)構造を持つことが示唆された。
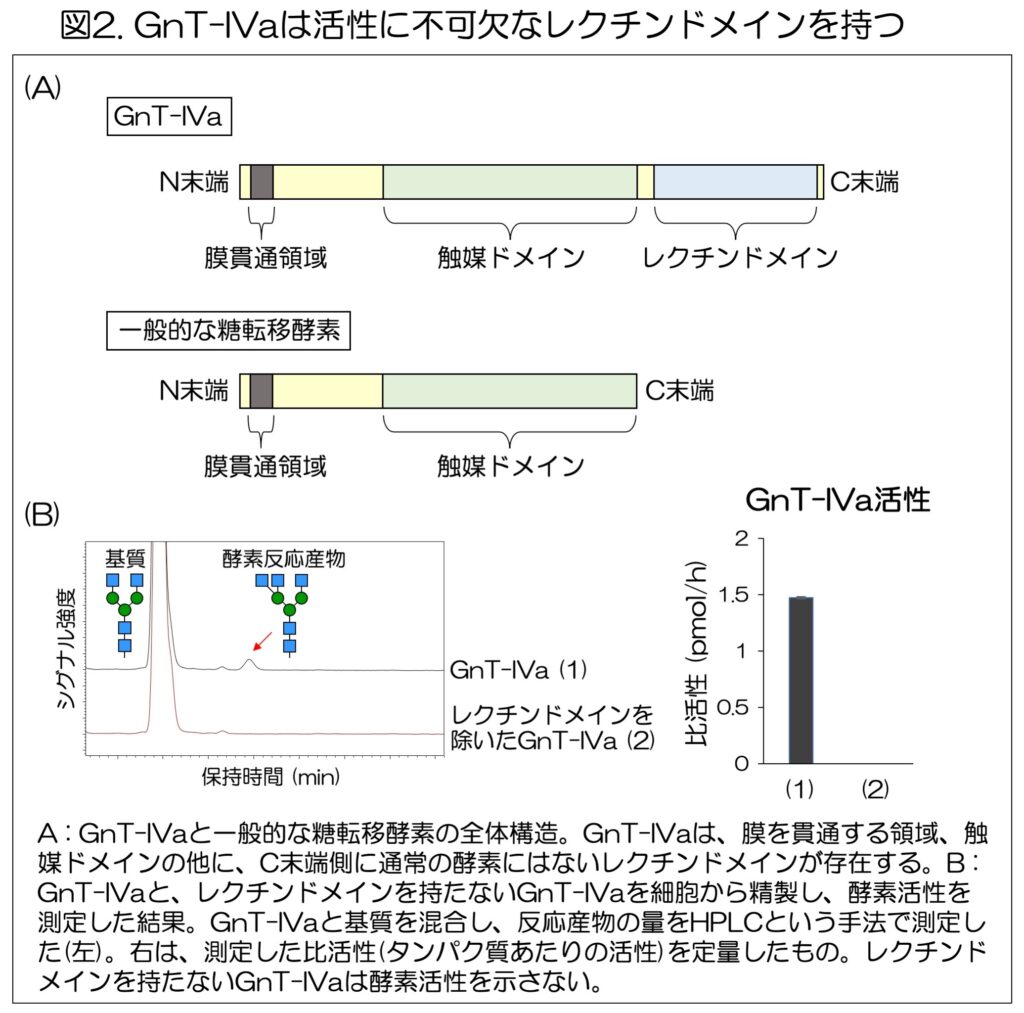
Phyre2と呼ばれるタンパク質の立体構造を予測するツールを用いて調べたところ、GnT-IVaは糖鎖をつくる触媒ドメインの他に、C末端側にレクチンドメインと呼ばれる領域の存在が明らかになった(図2A)。
レクチンとは、様々な糖鎖と選択的に結合するタンパク質で、GnT-IVaはC末端側のレクチンドメインで特定の糖鎖と結合することを示唆している。さらに、多くの糖転移酵素はこのようなレクチンドメインを持たないため、GnT-IVaは他の酵素とは異なるユニークな仕組みで糖鎖を作る実態が示唆された。
レクチンドメインのGnT-IVa酵素活性における役割を明らかにするために、まず、GnT-IVa、またはレクチンドメインを欠損させたGnT-IVaの変異体をそれぞれ細胞に発現させて精製した。
精製した酵素を試験管の中で基質の糖鎖と混合し、生じた酵素反応の産物をHPLC(高速液体クロマトグラフィー)で分析した(図2B左)。
その結果、レクチンドメインを除いたGnT-IVaは、酵素活性を示さないことがわかった(図2B右)。この発見によりGnT-IVaのレクチンドメインは、酵素活性を発揮するのに不可欠であることが明らかになった。
次に、レクチンドメインの働きや立体構造について、その詳細を調べた。レクチンドメインは糖鎖と結合する可能性が高いため、どのような種類の糖鎖と結合するのか、N型糖鎖やO型糖鎖などを含む157種類の糖鎖を対象に、フロンタルアフィニティークロマトグラフィー9)と呼ばれる手法で調べた。
その結果、GnT-IVaのレクチンドメインは、限られた構造を持つN型糖鎖とのみ結合することがわかった(図3)。
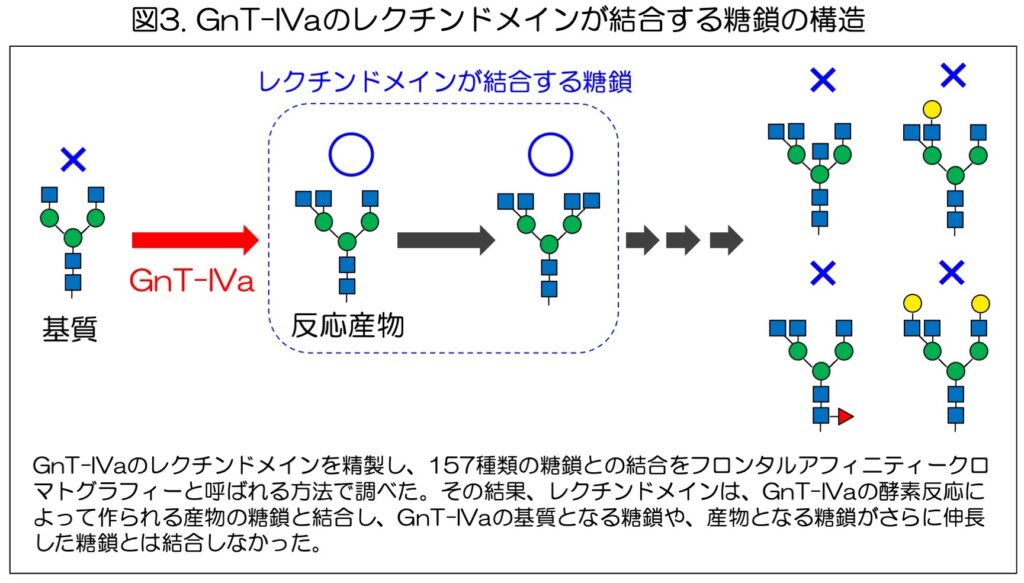
具体的には、GnT-IVaが作る枝分かれ構造を持ったN型糖鎖と特異的に結合した。一方、GnT-IVaの基質となるような糖鎖や、伸長が進んでより複雑な形になった糖鎖とは結合しなかった。
また、O型糖鎖など他の種類の糖鎖とも結合しなかった。これらの結果から、GnT-IVaのレクチンドメインは、触媒ドメインが作った直後の産物糖鎖と結合することが明らかになった。
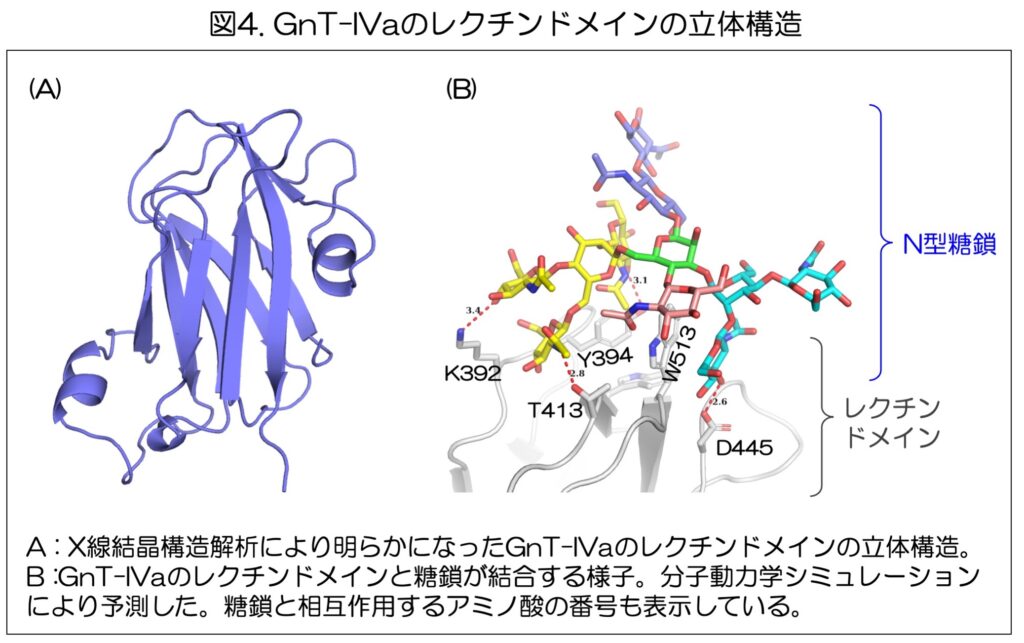
さらに、レクチンドメインの役割の詳細を明らかにするため、精製したレクチンドメインを用いて、X線結晶構造解析という手法で、その三次元構造の解明に成功した(図4A)。
次に、明らかになった立体構造をもとにレクチンドメインが糖鎖とどのように結合しているかを解明するため、分子動力学シミュレーションを用いた。
その結果、上述の結果と一致して、GnT-IVaのレクチンドメインは、触媒ドメインが作る枝分かれ構造を持ったN型糖鎖と強く相互作用する実態が解明された(図4B)。
また、GnT-IVaの445番目のアミノ酸であるアスパラギン酸(D445)が、この相互作用に極めて重要であることも判明した。
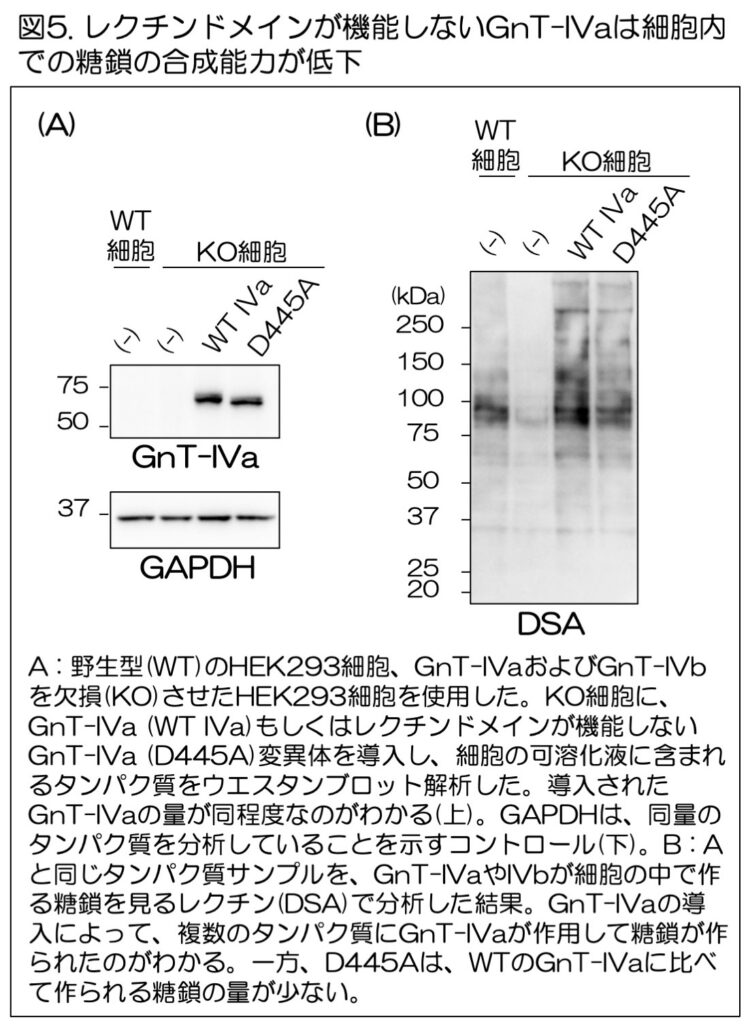
最後に、GnT-IVaが実際に細胞内でタンパク質に働くときのレクチンドメインの役割を調べるため、レクチンドメインの糖鎖結合能に不可欠なアミノ酸(D445)をアラニンに置換し、レクチンドメインの機能を喪失させた変異体(D445A)を細胞に発現させて、その機能を調べた(図5)。
DSA(Datura stramonium agglutinin、チョウセンアサガオレクチン)というレクチンを用いれば、GnT-IVaがタンパク質の上に作る糖鎖を検出できる。実際に、GnT-IVaおよびGnT-IVaと同じ糖鎖を作る活性を持つGnT-IVbという2つの酵素を欠損させて、GnT-IVの活性を完全になくした細胞(KO細胞)のタンパク質では、DSAとの反応性が大きく低下しており(図5B)、この方法でGnT-IVaが細胞内で作る糖鎖を検出できた。
さらに、KO細胞に通常のGnT-IVa(WT IVa)またはD445A変異体を発現させ、タンパク質の上に糖鎖がどの程度作られているかについてDSAを用いて調べた。
その結果、D445A変異体を発現させれば、WT IVaよりも細胞内でタンパク質の上に作られる糖鎖が少ないことがわかった(図5B)。
これらの結果から、GnT-IVaが細胞内でタンパク質に効率的に糖鎖を作るためには、レクチンドメインと糖鎖との結合が必要であることが明らかになった。
以上より、GnT-IVaは一般的な糖転移酵素とは異なりレクチンドメインを持っており、このレクチンドメインが触媒ドメインの作る糖鎖との選択的な結合により、酵素の効率的な糖鎖合成を可能にしていることが判明した。
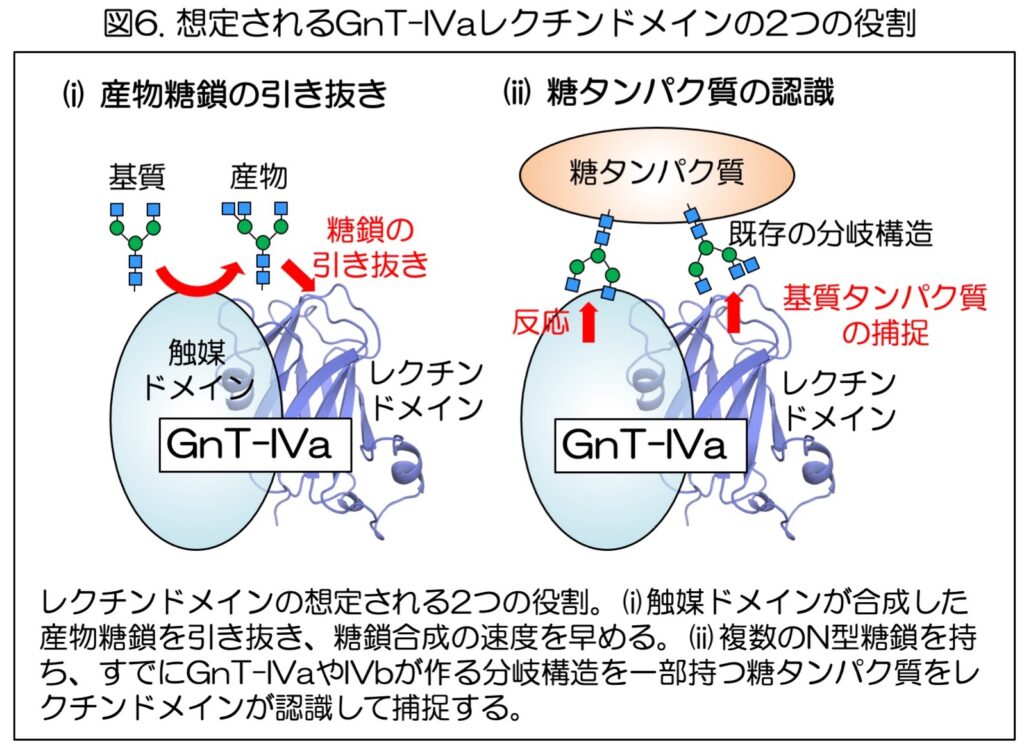
これらの結果から、GnT-IVaのレクチンドメインは、(i)酵素反応過程で触媒ドメインが作った産物糖鎖を引き抜くのに働いている、または、(ii)複数のN型糖鎖の一部にGnT-IVaやIVbが作った分岐構造をすでに持つ糖タンパク質を捕捉するのに働いている可能性が考えられる(図6)。
同研究により、GnT-IVaのレクチンドメインの構造や、このドメインを介したユニークな反応機構の存在が明らかになった。また、木塚氏らは、最近、N型糖鎖の別の分岐構造を作るGnT-Vと呼ばれる酵素においても、触媒ドメインとは別のドメインを介して基質となるタンパク質を認識することを明らかにしている(https://www.gifu-u.ac.jp/about/publication/press/20220131.pdf)。 これらの知見は、それぞれの糖転移酵素が独自の機構で基質タンパク質に作用して複雑な糖鎖を作り上げていることを示唆している。
一方、GnT-IVaのレクチンドメインと糖鎖との結合がどのようにして効率的な酵素反応に寄与しているのか、その詳細はまだ明らかになっていない。今後、触媒ドメインを含むGnT-IVa全体の立体構造がわかれば、GnT-IVaの働く仕組みがさらに解明されると期待される。
また、同研究は、糖鎖一般においてまだ未解明である「タンパク質ごとに異なる糖鎖がつく仕組み」を考える上で重要な知見を与えるとともに、糖鎖が関わる糖尿病の発症の仕組み解明に貢献するものと期待される。