カオスのような消化管全体での薬物動態を定量的に解析

医薬品のモダリティが多様化、複雑化し、売上高上位の医薬品の大半を注射薬が占めるようになった。だが、患者のQOLや経済性の観点から経口医薬品へのニーズはますます高まっている。薬物動態研究を専門とする昭和薬科大学薬学部教授の白坂善之氏(薬剤学研究室)は、「創薬において、経口医薬品こそ、目指すべき着地点である」と強調する。
こうした背景を踏まえて、白坂氏が挑戦しているプロジェクトの一つは、消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルの開発である。
白坂氏は「これまでの薬物吸収研究は、薬物が管腔側から腸上皮細胞を通過して血管側に至る透過過程のみを対象としたものがほとんどだったが、それは消化管吸収現象の一部に過ぎない」と指摘し、「消化管全体の薬物動態を理解するには、X軸、Y軸、Z軸の3次元的な薬物動態研究を行う必要がある」と独自の方法論を展開する。
X軸は、薬物が管腔側から腸上皮細胞を通過して血管側に至る透過過程である。Y軸は薬物が口腔から入って食道、胃、十二指腸、空腸、回腸、大腸、肛門に至る垂直的な動態で、「移動(滞留)時間、輪状ヒダや絨毛などの部位構造、水分やpH、腸内細菌叢などの生理環境、消化酵素の発現などの生理機能、飲食物や異物などの外的要因、年齢や疾患などの内的要因など、多数の要素が薬物動態に影響する」と白坂氏。
最後のZ軸はいわゆる製剤特性や技術であり、剤形、製剤の崩壊性、原薬の溶解性、特殊製剤化、添加剤などが消化管内の薬物動態に影響する。
「これだけの要素が関係する消化管からの薬物吸収を科学することは、まさしく“カオス”だが、私はこれら多数の要素を生物学的実験(ウェット)により解明し、その成果を速度論的解析(ドライ)により整理することで、薬物の吸収率や血中濃度を理論的に算出する数理モデルの開発に挑んでいる」と述べる白坂氏。その上で、「この研究は創薬に貢献することを目指しているが、その研究成果は臨床現場での投与設計や医薬品適正使用にも生かすことができる」と意義を語る。
水の摂取量で変動する薬物吸収率を算出するモデルを構築
白坂氏はこうした多数の要素を踏まえた革新的な薬物吸収予測システムの開発を行うにあたり、これまであまり着目されてこなかった個々の要素の研究を進めている。代表的な研究は、消化管内の水分挙動である。
「消化管からの薬物吸収を予測する上で最も重要なパラメータは消化管内での薬物濃度だが、濃度を決定する大きな要因の一つが水分量だ。そんな当たり前のことすら、今までほとんど研究されてこなかった」
白坂氏はラットを用いて、消化管内の水分量を測定する実験を行った。ラットに水1ml(ヒトの250mlに相当)を飲ませると、時間の経過とともに空腸、回腸、大腸から水分量が減少し、30分後に約40%になった。水が消化管から吸収されるからであり、結果として消化管内の薬物濃度は上昇(濃縮)する。
だが、水ではなく、アップルジュースを飲ませると消化管内の水分量は時間依存的に増加して30分後に約160%になった。
白坂氏は「この現象は、生体の浸透圧(約300 mOsm/L)より高い溶液を飲ませた場合、生体はそれを希釈するために水分を分泌して等張にするから起きる。薬と一緒に飲む物によって消化管の中の薬物濃度が変わってしまう」と説明する。
追加試験により、同じ薬を水で飲んだ場合に比べ、アップルジュースで飲んだ場合の消化管吸収率は3分の1に低下すること、アップルジュースと等しい浸透圧溶液でも同様の結果になることを証明した。
では、同じ水を摂取した場合、その摂取量によって薬物吸収率は変化するのか。例えば、ヒトがアモキシリンを250mlの水で飲んだときの血中濃度推移に比べ、25mlの水で飲んだときの血中濃度推移は低いことが報告されている。だが、なぜ、そうなるのかは分かっていない。
そこで、白坂氏は共同研究者の力を得て、半導体ナノ粒子「量子ドット」を用いた最新イメージング技術と、生体組織内のいくつかの組成物質を変化させて光の屈折率をゼロにする組織透明化技術を融合・導入し、消化管における環境、機能、構造、挙動などを詳しく解析した。
さまざまな実験を繰り返して、白坂氏がたどり着いた仮説は「水の摂取量が減ると、消化管へ水が接触する面積が減少するのではないか。薬物吸収に関与する部位の面積が減るから吸収率が落ちる」というものだった(図1)。
白坂氏はラットに量子ドットを飲ませ、一定時間経過した後に消化管全体(胃から大腸まで)を透明化して詳しく解析した。ラットに水を飲ませると、水は消化管の筒全体を伝って流れ落ちるのではなく、筒の一部だけに接触しながら流れ落ちていた。次に水の摂取量を増加させると、消化管への接触面積は水の摂取量に依存して増大した。
さらに、動物に摂取量を変えた水と薬物を摂取させ、実際に薬物吸収率を調べる実験を行った。その結果、水の摂取量と消化管での接触面積、薬物吸収率に相関関係があることを証明し、水の摂取量から薬物吸収率を算出する数理モデルを構築した。
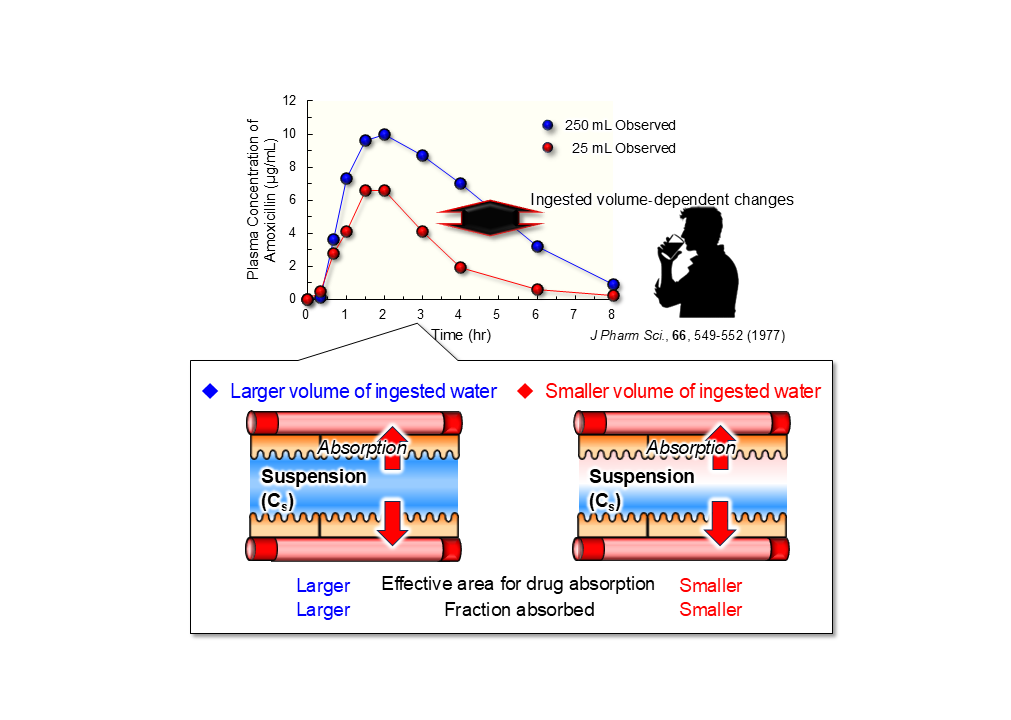
図1 水分の摂取量と消化管接触面積の関係とその薬物吸収への影響
糞便の形成で変動する大腸からの薬物吸収
量子ドットと組織透明化のイメージング技術によって得られた新たな知見は他にもある。大腸では糞便が薬物を取り込んでしまうため、腸管からはほとんど吸収されないことである。
「最新イメージング技術によって、薬物が糞便に移行することが視覚的にも数値的にも確認できた。これも考えてみれば当たり前のことのようだが、これまでの薬物動態研究では便の影響は軽視されてきた。とはいえ、正確な薬物吸収予測を行うためには極めて重要な現象である。食物残滓から糞便が形成される過程から研究を進めようと思っている」と白坂氏は語る。
これまでの薬学の常識は「薬物を主に吸収するのは小腸であり、大腸からは吸収されない」であった。実は白坂氏は過去に行った研究で、ラットの大腸は小腸と同等の薬物吸収能を持つことを明らかにしている。だが、実際には大腸からはほとんど吸収されていないことも分かった。
「大腸には薬物吸収能があるのに、なぜ実際には薬物が吸収されないかが謎だったが、今回の消化管イメージングで糞便の影響であることが確認できた」と白坂氏は指摘する。続けて「であるなら、糞便の影響を排除できるような製剤技術開発や絶食状態での投薬などが考えられる。大腸における薬物は次の排便まで滞留するので、他の部位に比べて滞留時間が遥かに長い。難吸収性薬物を大腸デリバリーという新たな手法で経口化する戦略が有望だ」と展望を語る。
白坂氏が挑んでいる消化管全体の生理環境と薬物動態を考慮した薬物吸収性予測モデルの全体像(生理学的薬物吸収動態モデル)は図2の通りだ。特に水分と薬物の消化管内挙動に着目している点から、Integrated Liquid and Intestinal Absorption Drug (ILIAD)モデルと命名されている。
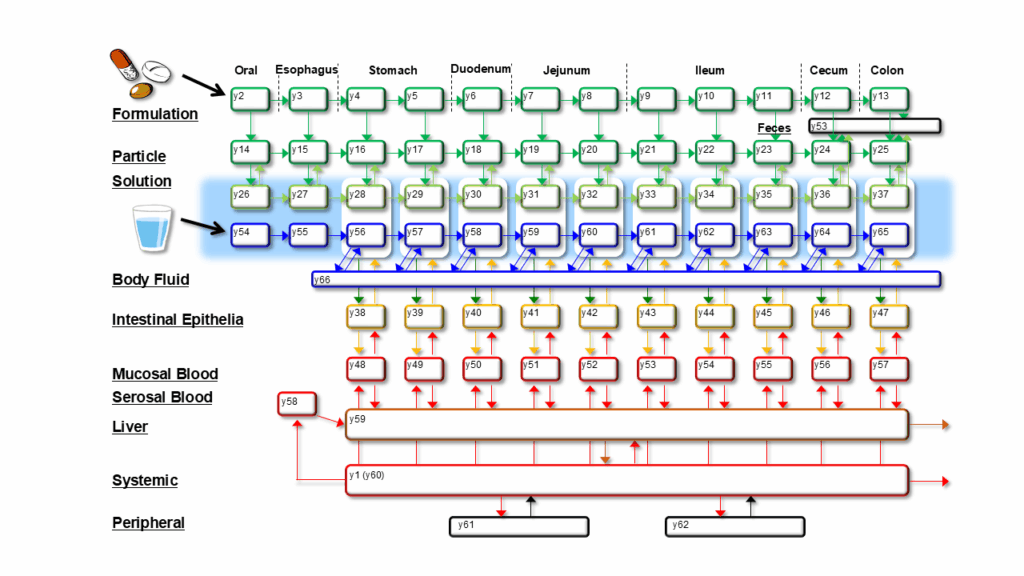
図2 消化管全体の生理環境と薬物動態を考慮した生理学的薬物吸収動態モデル(ILIADモデル)
横軸の各区画は、口から肛門までの消化管の各部位を表し、矢印には各部位間の薬物と水の移行速度が入る。縦軸は各部位での薬物挙動を表し、錠剤が崩壊して顆粒になり、顆粒が水や体液に溶けて薬液となり、消化管の上皮細胞を通過して血中に入り、全身に移行して最終的に排泄されるまでがモデル化されている。
白坂氏は「各区画をつなぐ矢印の全てに微分方程式を組むことにより、薬物の特性をインプットするだけで、薬物の吸収率と血中濃度推移が算出できる」と述べる。
加えて、「先に紹介した消化管内の水分挙動と接触面積、糞便形成と薬物蓄積、薬物吸収率の関連など、新たに発見された知見を数値として組み込み、より精度の高い薬物吸収予測を可能にしたい。実際に今までのモデルでは反映できなかった飲んだ水の量の変化による薬物血中濃度の変動も反映できるようになった。今後は、多様化、複雑化する創薬モダリティにも対応できる吸収予測を実現し、注射薬が広がる医薬品市場における経口薬ニーズに応えたい」と続ける。
白坂氏は、有効性だけでなく、安全な経口医薬品の創製にも貢献するとして、薬物の消化器毒性を予測する研究にも着手している。消化管で生成、分泌されるセロトニンに着目した消化器毒性評価システムの構築にも挑んでいる。今後の展開が期待される。


