日本イーライリリーは25日、アルツハイマー病による軽度認知障害および軽度の認知症治療薬「ケサンラ」について、同日、新しい用法・用量への変更における承認を取得したと発表した。
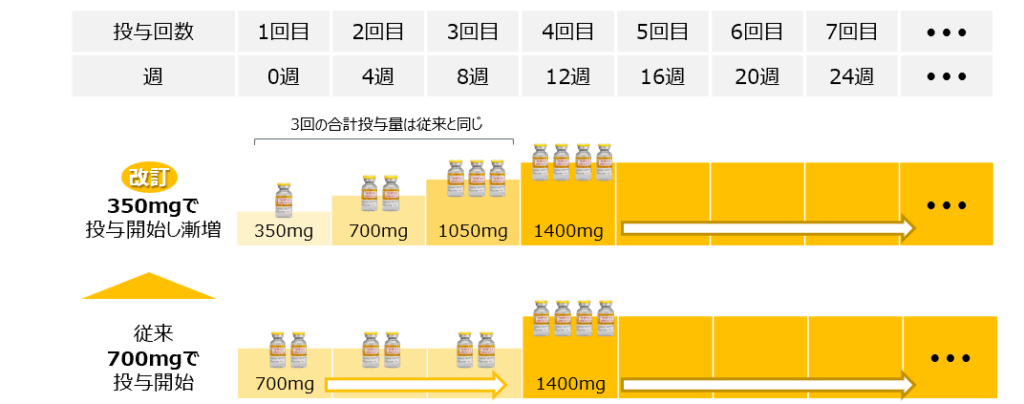
新たに承認された用法・用量は「通常、成人にはドナネマブ(遺伝子組換え)として初回は350mg、2回目は700mg、3回目は1050mg、その後は1回1400mgを4週間隔で、少なくとも30分かけて点滴静注する」
昨年9月の承認取得時の用法・用量は、「通常、成人にはドナネマブ(遺伝子組換え)として1回700mgを4週間隔で3回、その後は1回1400mgを4週間隔で、少なくとも30分かけて点滴静注する」で、新たな投与スケジュールでは、初回の投与分から3回目の投与分に1バイアルを移し、より段階的に投与量を増やしていく。
なお、24週目までの合計投与量およびそれ以降に投与されるケサンラの量は変わらない。今回の変更に伴い、今後、新たにケサンラで治療を受ける人は、従来の投与スケジュールと比較し、アミロイド関連画像異常-浮腫/滲出液貯留(ARIA-E)の発現割合の低下が認められた新しい投与スケジュールで治療を受けることになる。
今回の新しい用法・用量への変更承認は、TRAILBLAZER-ALZ 6試験の結果に基づくもの。同試験は、脳内アミロイドβ病理を示唆する所見を有する早期アルツハイマー病の当事者を対象に、ケサンラの投与方法の違いによるARIA-E関連事象の発現割合やアミロイドβプラーク沈着への影響等を検討する目的で実施された。ARIA-Eの多くは無症状であるが、重篤となる場合や生命を脅かす可能性もある。
試験の結果、主要評価項目である24週時におけるARIA-Eの発現割合は、新しい投与スケジュール群で13.7%、従来の投与スケジュール群で23.7%で、相対リスクが40.5%低下した。
また、副次評価項目である脳内アミロイドβプラーク沈着のベースラインから76週時までの変化量は、新しい投与スケジュール群で70.92センチロイド、従来の投与スケジュール群で72.14センチロイドの低下が認められ、明らかな違いは認められなかった。
新しい投与スケジュールを用いる場合でも、アミロイドPET検査等でアミロイドβプラークの除去が確認された場合にケサンラの投与を完了できる利点は変わらない(除去が確認されない場合でも、原則、最長18ヵ月で投与を完了する)。
ケサンラは、脳内のアミロイドβプラークの除去を目的に創製されたヒト化抗N3pGアミロイドβモノクローナル抗体製剤である。日本イーライリリーは、2024年9月に「アルツハイマー病による軽度認知障害及び軽度の認知症の進行抑制」を効能・効果に、ケサンラの日本国内における製造販売承認を取得している。
◆小松靖也日本イーライリリー ニューロサイエンス事業本部本部長のコメント
日本における承認取得から約1年のタイミングで、ARIA-Eの発現リスクの低下が期待される新しい投与スケジュールを案内できるようになったことを大変嬉しく思う。
当社は、適正使用推進のために速やかな情報提供活動を行い、今後もケサンラを通して、「自立した生活を維持したい」、「住み慣れた家や地域で暮らし続けたい」と考えている早期アルツハイマー病の当事者の皆さんに貢献していく所存である。


