リリーは17日、早期アルツハイマー病治療薬「ケサンラ」について、米国FDAがより段階的な漸増を行う早期アルツハイマー病の新しい用法・用量を承認したと発表した。
ケサンラは、軽度認知障害(MCI)および軽度認知症の段階において、アミロイドβ病理を示唆する所見が確認された早期アルツハイマー病(AD)の成人を対象に、4週間隔で投与する、アミロイドβプラークを標的とした治療薬である。
TRAILBLAZER-ALZ6試験では、ケサンラの変更した投与スケジュールにより、24週および52週時に、アミロイド関連画像異常-浮腫/滲出液貯留(ARIA-E)の発現割合が、従来の投与スケジュールと比較して有意に低下した。また、従来の投与スケジュールと同程度のアミロイドβプラークの除去およびP-tau217の減少も達成した。
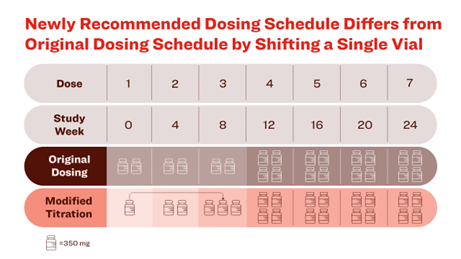
新たに推奨される投与スケジュールは、より段階的な漸増を行うもので、TRAILBLAZER-ALZ6試験では、従来の投与スケジュールと比較して、ARIA-Eの発現割合が24週で41%、52週で35%有意に低下し、それぞれ14%、16%でした。ARIA-Eは、ケサンラを含むアミロイドβプラークを標的とする治療薬に共通する副作用である。
ARIA-Eの多くは無症状ですが、重篤となる場合や生命を脅かす事象となる可能性もある。新しい投与スケジュールでは、初回の投与分から3回目の投与分に1バイアルを移すが、24週目まで及びそれ以降に投与されるケサンラの量は変わらない。
この投与スケジュールを用いることにより、ARIA-Eの発現割合が低下したが、ケサンラのアミロイドプラーク除去効果や、4週に1回の投与スケジュール、アミロイドプラークが低いレベルまで除去された時点で治療を完了できる可能性といった利点は損なわれなかった。
今回の添付文書改訂の基となったTRAILBLAZER-ALZ 6試験の主な結果は次の通り。
◆同試験の主要評価項目は、24週までにARIA-Eが発現した参加者の割合でした。ARIA-E発現割合は、変更した投与スケジュールで漸増投与を受けた群で14%、従来の投与スケジュールを用いた群で24%であり、相対リスクが41%低下した。
◆52週時点では、ARIA-E発生割合は、変更した投与スケジュールで漸増投与を受けた群で16%、従来の投与スケジュールを用いた群で25%であり、相対リスクが35%低下した。
52週時点では、無症状でMRIでのみ検出されるものも含め、変更した投与スケジュールで漸増投与を受けた群の29%にARIAが、16%にARIA-Eが、25%にARIA-Hの発現が認められた。ARIA-EとARIA-Hは異なるタイプのアミロイド関連画像異常(ARIA)である。浮腫を伴うARIAはARIA-Eで、ヘモシデリン沈着を伴うARIAはARIA-Hに分類される。
◆変更した投与スケジュールで漸増投与を受けた群と従来の投与スケジュールを用いた群のアミロイドβプラークおよびP-tau217の減少は同等であった。TRAILBLAZER-ALZ 6試験の主要評価項目である24週時点でのアミロイドPET検査において、アミロイドβプラークのレベルは、変更したケサンラの投与スケジュールで漸増投与を受けた群ではベースラインから平均67%減少し、従来の投与スケジュールを用いた群では69%減少した。
◆同試験では新しい副作用は確認されなかったが、過敏症反応およびinfusion reactionの発現割合の高さが認められた。
米国FDAは、P3試験(TRAILBLAZER-ALZ 2試験)データに基づき、2024年7月にケサンラを承認した。同試験では、ケサンラが早期ADの中でも病理学的により早い段階にある当事者の認知機能および日常生活機能の低下を、18ヵ月時点において、プラセボと比較して最大35%、より進行した段階の当事者を含めた試験の全体集団でも22%遅らせることが示され。
ケサンラの投与群において、同じ期間に次の臨床病期に進行するリスクは37%低下した。認知機能および日常生活機能の低下は、より深刻な記憶と思考の問題、日常の活動の困難さの増加、および介護者からの支援の必要性の増加によって評価された。
◆Brandy Matthewsリリーグローバル・米国AD域メディカル・アフェアーズを統括するバイスプレジデント(医師)のコメント
ケサンラの今回の添付文書改訂は、医療従事者が当事者に適した治療選択肢を検討する上で、大変役立つと確信している。今回の改訂は、ARIA-Eのリスクを軽減することにより、当事者の皆さまの安全とAD治療の進展に対する当社の揺るぎないコミットメントを示している。
◆Elly Leeアーバイン臨床研究センター最高医学責任者兼主任研究者のコメント
今回改訂された用法用量は、当事者とケアをされている方々にとって意義のある進歩である。ARIA-Eのリスクを大幅に低減することで、アミロイドを減少させる能力を維持しながら、当事者とケアをされる方々にケサンラの安全性に対する安心感を提供することができる。