武田薬品は22日、大腸がん治療薬「フリュザクラ」を同日から販売したと発表した。適応症は、がん化学療法後に増悪した治癒切除不能な進行・再発の結腸・直腸がん。薬価は1mg: 5139.40円 / 5mg: 2万3866.90円。
フリュザクラは、日本においてここ10年以上の間で初のバイオマーカーの状態にかかわらない転移性大腸がん(mCRC)に対する新しい経口の分子標的治療薬となる。
同剤は、血管内皮増殖因子受容体(VEGFR)1/2/3に対して選択性を有する経口のチロシンキナーゼ阻害剤で、VEGFR阻害薬は腫瘍血管新生の阻害において極めて重要な役割を果たす。
標的外のキナーゼ活性を最小限に抑えることによって、高い選択性を有するようデザインされているフリュザクラは、持続的な標的阻害を成し遂げる薬物曝露を可能とし、併用療法の一部として使用する柔軟な可能性を有している。
武田薬品は、中国本土、香港、マカオを除く全世界におけるフルキンチニブのグローバル開発、商業化および製造を進めるための独占的ライセンスを有している。フリュザクラは2023年11月に米国FDA、2024年6月に欧州委員会(EC)、2024年9月に日本において厚労省により承認された。
フルキンチニブは中国ではHUTCHMED社により開発および販売されている。フルキンチニブは2018年9月に中国国家食品薬品監督管理局(NMPA)により販売承認され、2018年11月に中国でELUNATEの販売名で上市されている。
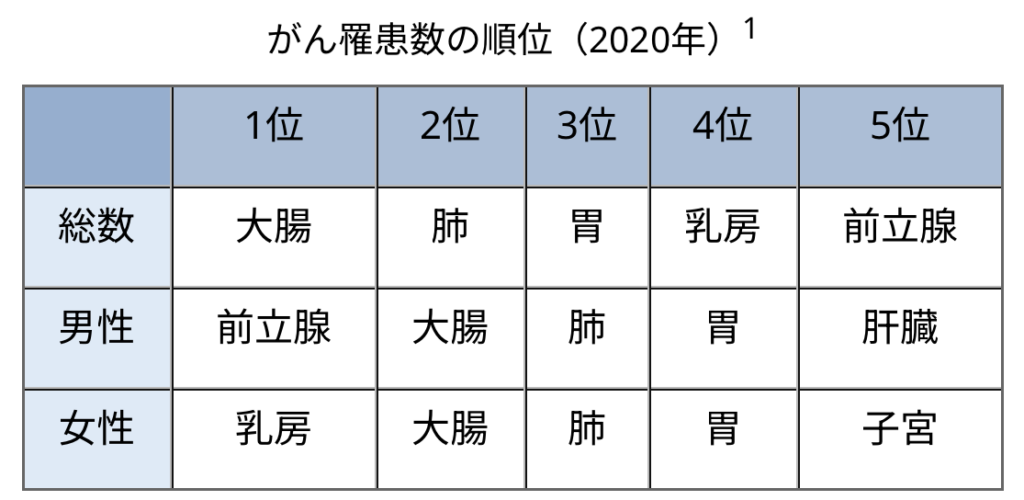
日本では、大腸がんは男女合わせると最も罹患数の多いがんとなっており、2023年の予測罹患数は16.1万人、死亡数は5.4万人と推定される。早期の大腸がんは外科的切除が可能で予後が良好であるが、mCRCは依然として予後不良で、5年生存率は17%となっている。mCRCの領域は、治療選択肢が限られており、アンメットニーズが高く、新たな治療オプションが待ち望まれている。
フリュザクラは主に、米国、欧州、日本およびオーストラリアで前治療歴を有するmCRC患者を対象として実施された国際共同P3試験であるFRESCO-2試験の結果に基づき、2023年9月29日に厚生労働省に製造販売承認申請を行い、2024年9月24日に製造販売承認を取得した。
◆内田智武田薬品日本オンコロジー事業部長のコメント 当社は、日本において10年以上にわたりmCRCの治療の進展に取り組んできた。フリュザクラを通じて、日本のmCRCの治療に、より一層貢献できるようになる。新たな治療選択肢を待ち望まれている大腸がん患者さん・ご家族に本治療薬が提供できるよう引き続き尽力していく。


