富士通と理化学研究所は10日、生成AIを活用し、大量の電子顕微鏡画像からタンパク質の構造変化を広範囲に予測できるAI創薬技術を本年1月に開発したと発表した。
同共同研究は、創薬の開発期間や費用を劇的に削減する次世代IT創薬技術の開発などを目指して昨年5月に開始されたもの。
生命活動や病気のメカニズムと深く関わっているタンパク質は、柔軟で、さまざまな形態をとることで生体内の他の分子と相互作用している。例えば、ウイルスへの感染を抑制する薬を効率的に設計するには、薬の標的となるタンパク質の形態や構造変化の様子を把握することが重要である。
だが、標的タンパク質の広範囲な構造変化を捉える上では、高度な専門知識や長期におよぶ研究期間、多くの研究開発費用が課題であった。
そこで、共同研究では、標的タンパク質の大量の電子顕微鏡の画像から、その立体構造の多様な形態とそれらが取り得る割合を正確に推定する生成AI技術と、推定された割合から標的タンパク質の構造変化を予測する技術を開発し、それら二つの技術を基にタンパク質の構造変化を3D密度マップの連続的な変形として予測できるAI創薬技術を開発した。
両者は、同技術に関する論文を、2023年10月10日(日本時間)に、医療用画像処理分野のトップ国際会議「MICCAI 2023」で発表した。
この技術は、従来の手順に比べて10倍以上高速に大量の電子顕微鏡画像からタンパク質の形態と構造変化の推定が可能になるため、細菌やウイルスなどの標的タンパク質に結合する薬剤の設計過程の革新が期待できる。
両者は今後、今回開発した生成AI技術を、標的タンパク質と抗体の複合体解析や分子の大域的な構造変化を高精度かつ高速に予測する次世代IT創薬技術を実現するためのコア技術のひとつとして活用していく。
また、富士通は、タンパク質の構造変化の予測技術を、先端技術を素早く試せるAIプラットフォーム「Fujitsu Kozuchi (code name) – Fujitsu AI Platform」のAIイノベーションコンポーネントとして、2023年10月10日より提供開始した。
生物の生命活動や病気のメカニズムと深く関わっているタンパク質は非常に柔軟で、さまざまな形態を取り得ることで生体内の他の分子と相互作用している。例えば、ヒトに感染するウイルスが体内に侵入するには、ウイルス表面のタンパク質の形態が変化して細胞表面のタンパク質と結合するため、感染を抑制する薬を効率的に設計するには、ウイルス表面におけるタンパク質の多様な変化の形態を知ることが重要となる。
だが、タンパク質はそれぞれの原子が3次元の座標を持ち、原子数×3の次元を持つ高次元データとなる。こうした高次元空間で標的タンパク質の広範囲な構造変化の情報を得るには、高度な専門知識と試行錯誤が必要となり、長い期間と多くの費用が必要であった。
この課題解決に向けて、富士通と理研は、独自の生成AI技術とスーパーコンピュータ「富岳」で処理した大規模な画像データを活用することで以下の二つの新たな技術を開発した。
タンパク質の広範囲な構造変化を予測するためには、最初に構造の割合を推定し、次に構造の時間変化を正確に推定するという2つのステップの推定を実現する必要がある。
富士通独自の生成AI技術「DeepTwin(ディープツイン)」と理研の創薬分子シミュレーションの知見を応用して開発した二つの技術を活用して、標的タンパク質の構造変化の予測を従来の1日から2時間に短縮することが可能となった。今回開発した技術は、製薬企業の創薬プロセスの迅速化・効率化への貢献が期待される。
具体的には、二つの新しい創薬技術として、①タンパク質の立体構造の多様な形態と割合を正確に推定する生成AI技術、②タンパク質の立体構造の低次元特徴量をもとに構造変化を予測する技術ーがある。
広範囲な構造変化の正確な予測には、標的タンパク質がどのように変化するのか、その形態の割合を正確に捉える必要がある。
今回標的タンパク質のある瞬間をとらえた大量の投影画像と投影角から投影対象を組み立てる計算をして立体構造の多様な形態を3D密度マップとして復元すると同時に、復元された立体構造の各形態への変化の頻度を手掛かりに標的タンパク質が取り得る形態の割合を実験データに基づく形で見積もることを可能にした。
標的タンパク質の立体構造は通常、高次元データであるため、その構造変化を直接分析するのは困難だ。そこで、今回低次元化された特徴量を用いて化学分野で使われる反応経路の分析を適用可能にする技術を開発した。
低次元での分析結果を独自の生成AIにより元の高次元データに復元することで、標的タンパク質の構造変化の予測を実現した。
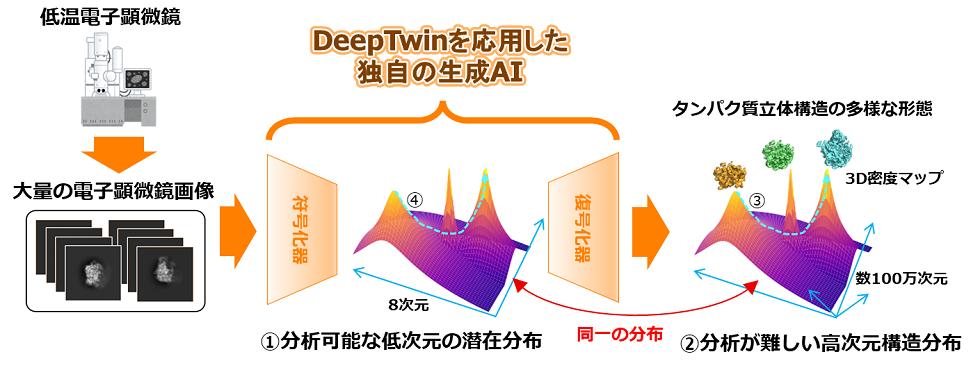
顕微鏡で十分大量に撮影された画像で符号化器と復号化器を訓練する。
訓練後には分析が難しい構造分布②と同等な低次元の分布①を潜在空間で得ることができると同時に、
復号化器を通して低次元特徴量に対応する3D密度マップに復元できる。
両者は今後、今回開発したAI創薬技術を、標的タンパク質と抗体の複合体解析や分子の大域的な構造変化を高精度かつ高速に予測するためのコア技術の一つとして活用していく。
理研は、医薬分野におけるSociety 5.0の実現に向け、「富岳」への創薬DXプラットフォーム構築を進めており、標的タンパク質の多様な構造状態を推定する新たな技術の一つとして活用することで創薬プロセスの革新を目指す。
また、現在、理研では、今回の成果のように、自らの強みである最先端研究プラットフォーム群(スーパーコンピュータ「富岳」、バイオリソース事業など)を有機的に連携させ、新たな知の領域を、研究分野を超えて効果的に生み出す革新的な研究プラットフォームの創出を目指した様々な取組み(TRIPなど)を推進している。
富士通は、タンパク質の構造変化の予測技術を、先端技術を素早く試せるAIプラットフォーム「Fujitsu Kozuchi (code name) – Fujitsu AI Platform」のコアエンジンとして、10月10日より提供開始している。富士通はサステナブルな世界の実現を目指す「Fujitsu Uvance」の下、あらゆる人のライフエクスペリエンスを最大化する「Healthy Living」を推進している。
今後も富士通が強みをもつAIおよびHPCを組み合わせた技術開発を行うことで、医療分野における社会問題の解決に貢献していく。


