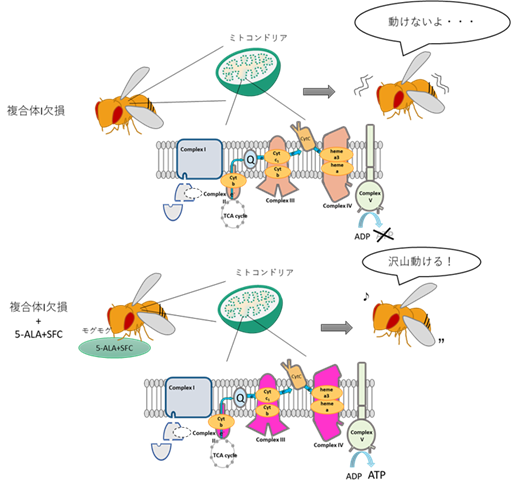
東京都立大学大学院理学研究科の安藤香奈絵准教授と野澤菜緒子氏らのグループは、ミトコンドリア電子伝達系の一部である複合体Iを欠損させたショウジョウバエに5-ALA-HCl+SFCを摂取させると、運動機能が大きく改善されることを発見した。
さらに、これらの個体では複合体Iを欠損したままII、IVの活性が上昇し、ATP量が増加したことから、複合体Iを迂回してATPが合成されることが示唆された(図1)。
ミトコンドリアは、電子伝達系生体のエネルギー分子ATPを産生し、その働きに関わる遺伝子の変異はミトコンドリア病の原因となる。
ミトコンドリア病はATPの産生低下による全身性の症状を示すが、特にエネルギー需要が高い脳や筋肉の症状が顕著に見られ、その根本的な治療法が求められている。
電子伝達系は4つの呼吸鎖複合体からなり、特に複合体Iの欠損はミトコンドリア病の原因の多くの割合を占める。
5-アミノレブリン酸(5-ALA)は、クエン酸第一鉄ナトリウム(SFC)と共に投与するとミトコンドリアを賦活することが知られる。
だが、電子伝達系欠損個体に対する効果はわかっていなかった。
こうした中、安藤氏らの研究から、ミトコンドリアのATP産生を促進する新たなメカニズムが明らかになった。この知見は将来、複合体I欠損による疾患の治療法の開発につながる可能性がある。
なお、同研究は、SBIファーマが17日に発表した「東京都立大学によるオックスフォード大学出版局の科学雑誌‟Human Molecular Genetics”への5-ALAに関する研究論文発表のお知らせ~5-ALA+SFCで電子伝達系複合体I欠損の症状改善の可能性~」で取り上げられた。研究成果のポイントは、次の通り。
◆複合体Iを欠損させたショウジョウバエでは、ピルビン酸や乳酸の蓄積、幼虫期での発達の遅れや致死、神経筋接合部の形成異常、成虫期での運動機能の低下や寿命の短縮が起きた。
複合体I欠損ショウジョウバエに5-ALA-HCl+SFCを摂取させると、ピルビン酸や乳酸の蓄積の低下、幼虫期での神経筋接合部の形成異常が改善し、成虫期での運動機能の低下が改善された。
◆5-ALA-HCl+SFCは、複合体I欠損個体で、複合体II以降の電子伝達系でのATP合成を亢進させた。
生体に必要となるエネルギーのほとんどはミトコンドリアで作られている。ミトコンドリアの呼吸鎖複合体(複合体I~IV)は電子の受け渡しを行い、ATP合成酵素が電子伝達系に溜まった電子を使用してエネルギー(ATP)を生産する(電子伝達系)。呼吸鎖複合体の異常はミトコンドリア病と呼ばれる多臓器障害を伴う遺伝病の原因となる。
特に、電子の最初の入口となる複合体Iの欠損は、電子伝達系異常によるミトコンドリア病の原因の1/3を占める。複合体I欠損は、特にエネルギーを必要とする心臓や筋肉、脳などに与えるダメージが大きく、神経症状など様々な臨床症状が現れる。
呼吸鎖複合体への電子の流入の一部は、複合体IIからも起こることが知られていた。すなわち、複合体II以降を利用したATP産生を増強できれば、複合体I欠損による異常を軽減できるかもしれない。だが、その増強の方法は知られていなかった。
呼吸鎖複合体の複合体II、III、IVとチトクロムcは、ヘムタンパク質を含む。ヘムの原料となる5-アミノレブリン酸塩酸塩(5-ALA-HCl)とヘムに必要な鉄源としてクエン酸第一鉄ナトリウム(SFC)を組み合わせて投与すると、様々なモデルでミトコンドリア賦活効果があることが知られていた。
そこで、今回、ショウジョウバエをモデルとして用い、複合体I欠損へのその効果を調べた。
まず、複合体Iのアセンブリ因子であるNDUFAF6のショウジョウバエのホモログであるsicilyを全身でノックダウンすることによって複合体I欠損ショウジョウバエを作成した。
その結果、sicilyノックダウンショウジョウバエでは、ピルビン酸や乳酸が蓄積し、幼虫期での発達の遅れや致死、神経筋接合部の形成異常が観察された。さらに成虫期では、運動機能の低下や寿命の短縮が起きた。しかし、5-ALA-HCl+SFCを含む餌で飼育すると、幼虫期での神経接合部の形成異常が減少し、成虫期での運動機能の低下が緩和され、ピルビン酸や乳酸の蓄積が減少した。
さらに、複合体Iは欠損したままだが、複合体IIと複合体IVの活性が上昇し、ATP量が増加していた。 これらの結果より、5-ALA-HCl+SFCは複合体Iを介さずにATP生産を促進していることが示された。
同研究成果により、5-ALA-HCl+SFCは複合体I 欠損を回避し、ATP産生を促進することで、ショウジョウバエの代謝異常を補正し、有害な表現型を緩和することが明らかになった。
複合体Iのバイパスという現象は知られていたが、個体レベルでそれを促進する化合物が同定されたのは初めてであり、ミトコンドリアのATP 産生の新たなメカニズムの解明につながる。
また、ミトコンドリア病には現在有効な治療法がないが、複合体Iバイパスの促進による根本的な治療薬の開発につながる可能性がある。


