セルサーカドヘリンの結合障害による疾患発症メカニズム解明に期待
自然科学研究機構 生命創成探究センター (ExCELLS) の西口茂孝特任研究員と名古屋大学大学院理学研究科の内橋貴之教授のグループは、細胞の極性形成に重要な細胞と細胞をつなぐ細胞間接着分子であるセルサーカドヘリンの結合構造のナノメートル (100万分の1mm)スケールでの可視化に世界で初めて成功した。同研究成果は、岐阜大学糖鎖生命コア研究所の笠井倫志特任准教授との共同研究によるもの。
研究グループは、1分子蛍光顕微鏡と高速原子間力顕微鏡を用いて、セルサーカドヘリン2分子がらせん状に絡み合って結合する結合メカニズムを明らかにした。セルサーカドヘリンを介した細胞間接着は、体毛の生える方向を決める細胞の極性形成や、脳神経のネットワークの形成等に重要であるため、セルサーカドヘリンの結合メカニズムを解明により、我々の複雑なからだの形作りやセルサーカドヘリンの結合障害によって生じる疾患発症の原理解明に繋がるものと期待される。
同研究成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences of the United States of America」 に4月24日(米国東部時間) に掲載された。
発表のポイントは次の通り。
1、細胞の極性形成に重要な細胞間接着分子であるセルサーカドヘリンの液中における結合構造を世界で初めて観察した。
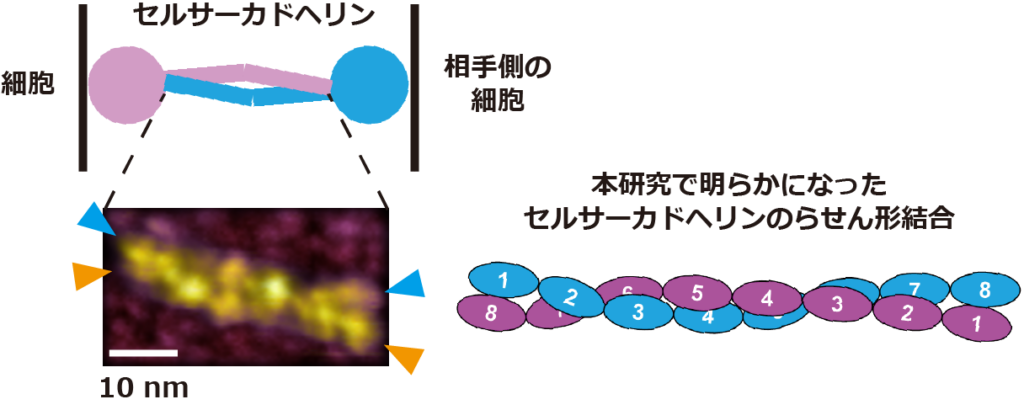
2、1分子蛍光顕微鏡と高速原子間力顕微鏡を用いて、セルサーカドヘリンの2分子が逆平行に相対して、らせん状に結合する結合メカニズムを明らかにした。
3、セルサーカドヘリンの結合メカニズムを解明することで、私たちの複雑なからだの形作りや、セルサーカドヘリンの結合障害によって生じる疾患発症の原理解明に繋がることが期待される。
我々の複雑なからだの形作りは、臓器や組織を構成する細胞同士の接着 (細胞間接着) によって制御されている。細胞間接着分子の一種であるセルサーカドヘリンは、体毛の生える方向や、神経細胞が移動する方向等の細胞の極性形成に重要であり、脳神経のネットワーク形成等の組織の複雑化にも関与することが知られている。
細胞や臓器を用いた実験により、セルサーカドヘリンの生理学的な重要性は明らかになっていたが、セルサーカドヘリンがどのようにして細胞と細胞をつなぐのかという結合メカニズムについては、セルサーカドヘリンを1分子のスケールで解析することが技術的に難しいため、これまで明らかにされていなかった。
そこで、研究グループは、異なる2色の蛍光分子で標識したセルサーカドヘリン(CELSR2-mGFP、CELSR2-Halo)を個別に発現する2種類の細胞を混合し、2種類の細胞と細胞の境界におけるCELSR2-mGFPとCELSR2-Haloの動きを1分子蛍光顕微鏡で追跡した。
1分子蛍光顕微鏡による観察の結果、細胞と細胞の境界において、2色の蛍光分子が同一箇所に局在しながら長時間 (~1秒) ・長距離 (~1マイクロメートル) 移動することが明らかとなり、セルサーカドヘリン2分子が細胞と細胞の間で結合することで細胞をつないでいることが示唆された (図1)。
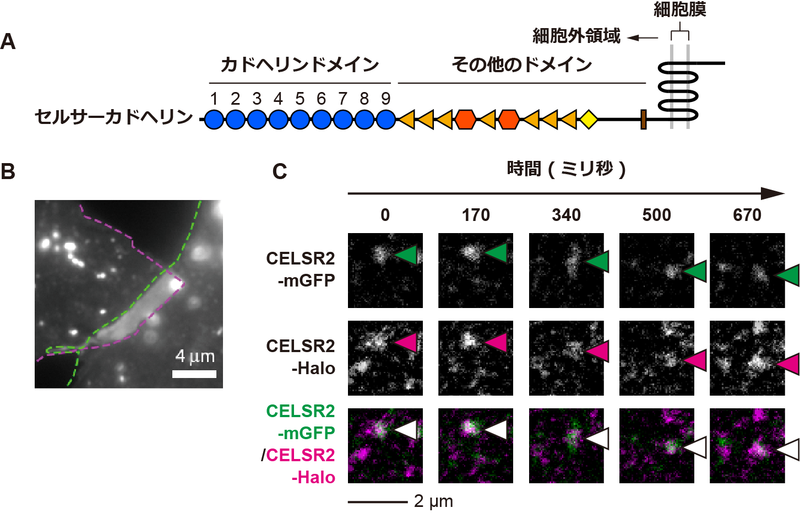
図1. 1分子蛍光顕微鏡による蛍光分子で標識したセルサーカドヘリンの観察. (A) セルサーカドヘリンのドメイン構成。セルサーカドヘリン間の結合を担う細胞外領域は9個のカドヘリンドメインとその他の複数のドメインから構成される。(B) 蛍光標識したセルサーカドヘリンを発現する細胞と細胞の境界の蛍光顕微鏡画像。緑とマゼンタで示した破線が隣り合う細胞の辺縁部を示している。隣り合う細胞が重なった領域でセルサーカドヘリンが濃縮していることから、細胞間界面で細胞間接着が生じている。 (C) 異なる2色の蛍光分子で標識したセルサーカドヘリンの1分子蛍光顕微鏡画像。2色の蛍光分子で標識したセルサーカドヘリン (CELSR2-mGFPとCELSR2-Halo) を別々に発現する細胞と細胞の境界で、2色の蛍光標識セルサーカドヘリンが同一箇所を移動していることから、2つの分子が細胞間で結合していることがわかる。
続いて、哺乳動物細胞から精製したセルサーカドヘリンの液中構造を、高速原子間力顕微鏡 (高速AFM) で観察した結果、セルサーカドヘリンはカドヘリンドメインと呼ばれるドメイン群から構成される棒状構造と、それ以外のドメイン群から構成される球状構造の2つの特徴的な構造を有しており、さらにカドヘリンドメインから成る棒状構造が逆平行に重なることで2つの分子が結合していることがわかった (図2)。
高速AFMで観察したセルサーカドヘリン2分子が逆平行に相対した結合構造は、1分子蛍光顕微鏡で観察した、隣り合う細胞間における2分子間の結合状態を反映していると考えられる。さらに、高速AFMで取得したセルサーカドヘリンの画像データに、近年開発された高分解能画像解析手法である局在化AFM法を適用した結果、セルサーカドヘリンを構成する細胞膜遠位側の8個のカドヘリンドメインが、らせん状に絡み合って相互作用することで、2分子間の結合構造が形成されることがわかった (図2)。
また、ビーズを用いたセルサーカドヘリンの結合活性評価により、8個のカドヘリンドメインの内、細胞膜遠位側から数えて4番目のカドヘリンドメインが2分子間の結合に特に重要であることが明らかになった。
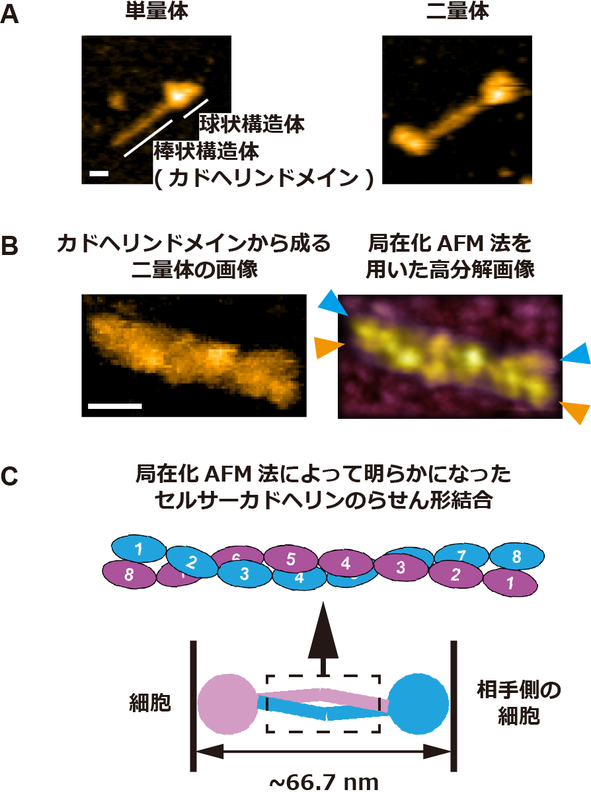
図2. セルサーカドヘリンの高速AFM画像. (A) セルサーカドヘリン1分子 (単量体) とセルサーカドヘリン2分子 (二量体) の高速AFM画像。カドヘリンドメインから構成される棒状構造体が逆平行に重なることで二量体が形成されている。 (B) 8個のカドヘリンドメインから成る分子の二量体の高速AFM画像 (左図) と局在化AFM法を適用した高分解能画像 (右図)。8個のカドヘリンドメインが全て重なり、かつらせん状に絡み合うことで二量体を形成している。色付きの矢頭は二量体を構成する個々の分子の両端を示す。 (C) 高速AFMと局在化AFM法によって明らかになったセルサーカドヘリンの結合モデル。AとBの高速AFM画像のスケールバーは10 nm。
同究結果は、これまで生理学的な重要性が報告されていたセルサーカドヘリンによる細胞間接着メカニズムの解明に大きく貢献する成果である。セルサーカドヘリンはカドヘリンと呼ばれる細胞間接着分子の一種ですが、過去に結合様式が報告されているクラシカルカドヘリンでは、2個のカドヘリンドメインが2分子間の結合に必要であることに対して、セルサーカドヘリンではこれまでに報告されているカドヘリンの中で最も多い、8個のカドヘリンドメインが細胞間の結合に関与することが同研究で明らかになった。
8個のカドヘリンドメインを介した2量体は、クラシカルカドヘリンの2量体 (37.3-38.5 nm) よりも2倍近く大きい (~66.7 nm) ため、セルサーカドヘリンが細胞間の距離を大きく保つことで、細胞間の情報交換に必要な細胞外小胞*7等の分子を通過させるためのスペーサーとして働く可能性を示している。
今後のさらなる詳細な解析の推進により、同研究で発見したセルサーカドヘリンの結合構造の機能的意義を明らかにすることが期待される。今後の研究展望では、次の3つのポイントが挙げられる。
1、同研究では、セルサーカドヘリンの結合様式および結合に必要な領域が明らかになった一方で、セルサーカドヘリンを構成する個々のドメインの詳細な役割について明らかにする必要がある。
今後、X線結晶構造解析やクライオ電子顕微鏡を用いた構造解析により、セルサーカドヘリンの各ドメインが2分子間の結合に与える影響を明らかにすることを予定している。
2、精製したセルサーカドヘリンの90%以上が、カドヘリンドメインから成る棒状構造を介した2量体を形成していた一方で、その他のドメインから成る球状構造を介した複合体もわずかに観察されたことから、セルサーカドヘリンは細胞膜の足場が存在する実際の細胞間隙では多様な結合構造を形成する可能性がある。
今後は、セルサーカドヘリンを発現する細胞や、セルサーカドヘリンを固定したリポソームを高速AFMやクライオ電子顕微鏡を用いて観察することで、より生理環境に近い条件での構造解析を予定している。
3、セルサーカドヘリンが細胞間隙を広げるスペーサーとして働くことで、細胞間の情報交換に必要な分子を通すという仮説を検証することは、セルサーカドヘリンの結合様式の機能的意義の解明に必要である。今後は、一部のドメインを欠損させた分子を培養細胞や動物個体で発現させることで、どのような影響が生じるかの解析を予定している。


