
2021年6月、FDAが18年ぶりとなるアルツハイマー病(AD)の新規治療薬アデュカヌマブを迅速承認し、認知症の創薬研究史に新たな一頁が書き加えられた。また、2021年4月に東京大学大学院薬学系研究科・富田泰輔教授(機能病態学)らの研究グループが雑誌Brainに掲載した論文は、光酸素化触媒を用いた新たなAD治療薬開発の可能性を示唆するものとして、大きな注目を集めている。
認知症の約70%を占めるADの研究は、1906年にアルツハイマー博士が多くの認知症患者の死後脳に、脳萎縮、老人斑、神経原線維変化の3つが見られることを示したことからスタートした。富田教授は、「1970年代に脳萎縮に対する研究が進み、神経伝達物質をターゲットとしたドネペジルなどの開発につながった。80年代には老人斑、神経原線維変化で観察される脳内の溜まりものの生化学的研究が進み、それぞれアミロイドβ(Aβ)、タウが蓄積していることが解明された。アデュカヌマブなどの抗体医薬やわれわれの研究も、80年代の研究の延長線上にある」と話す。
次の1990~2000年代に行われたのが、「溜まりものができたから神経細胞が死ぬのか、神経細胞が死んだから溜まりものができたのか」という問いに答える遺伝子研究だ。家族性AD患者の遺伝子変異検索などにより、ADの発症に関係する遺伝子が同定され、APP、プレセニリン1、2といった遺伝子の変異がAβの産生亢進や凝集増加を引き起こすことがわかった。2012年にはアイスランドの大規模ゲノム解析プロジェクトに基づく研究結果がNatureに掲載された。同研究は超高齢で認知機能を保っている人の遺伝子を検索し、ADから守っている予防的変異を見つけるというもので、Aβ産生を抑制するAPPの遺伝子変異が発見された。この幸運な遺伝子変異を持つのはアイスランド人の1家系のみであり、極めてまれなものだった。このように、Aβ産生の亢進や抑制をもたらす遺伝子変異が見つかったが、遺伝子の影響が小さな人にも、ADを発症する人、しない人がいる。2010年に行われた研究で、孤発性AD(家族性でないAD)では、Aβ産生量には変化がないが、クリアランス(分解・排出能力)が低下しているために脳内Aβ濃度が上昇していることが明らかになった。
一方、タウの蓄積は、AD以外のいくつかの神経変性疾患でも見られる。家族性前頭側頭葉変性症の研究では、タウの凝集性を高める遺伝子変異も見つかっていることから、タウの蓄積は神経細胞死に関わると考えられている。しかし、ADではタウに関連する遺伝子変異はまだ見つかっていない。 これらの長年にわたる研究結果から「Aβの蓄積がタウの蓄積を引き起こし、それが神経細胞死につながると推測される」と富田教授は強調する。
Aβを標的とした創薬研究としては、2000年代にAβ産生阻害薬の研究が精力的に進められた。例えば、Aβ合成に必要な2つの酵素の阻害薬などが開発されたが、いずれも治験で薬効がなく、副作用も認められたため、開発は中止された。現在、世界中で研究が進行しているのが、蓄積されたAβを減少させる治療薬である。1999年にシェンク博士がマウスによる実験で、Aβに対する能動ワクチン療法が脳内のAβ沈着を劇的に減少させた論文を発表したことを契機に急速に開発が進んだ。しかし、治験で急性脳炎による死亡例が出たため、研究の方向は能動ワクチンではなく、安全な抗Aβ抗体を人工的に作成して投与する抗体医薬(受動ワクチン)の開発へと転換した。一方、タウを標的とした医薬品開発も徐々に進みつつあるが、抗Aβ薬の開発に比べると10年ほど遅れているという。
抗Aβ抗体医薬の第1号がアデュカヌマブであり、他にも3つの抗体医薬がFDAのブレイクスルーセラピー指定を受けて臨床試験が進行中である。アデュカヌマブはFDAの迅速承認を取得したが、日本では今回、承認が見送られ、継続審議となった。臨床試験の結果や年間5万6000ドルという高薬価、副作用の問題などから議論を巻き起こしているが、富田教授は「遺伝学的な研究成果や大規模なバイオマーカー研究から、Aβ蓄積の減少がAD進行抑制をサロゲートするのは明らかだ。アデュカヌマブは治験デザインや認知機能の検査方法などに問題点があって議論の余地を残す結果になったと思っているが、脳内Aβ蓄積を減少させることは間違いない。同様の薬理作用を示す他の抗体医薬の試験結果を見守りたい」と述べる一方、「Aβは発症の15~20年前から蓄積し始めることがわかっている。すでに神経細胞死が進んだ時期に投与しても抗Aβ薬は効果を発揮しにくいため、Aβは蓄積しているが、まだ発症していないプレクリニカル期に投与する先制医療が重要だ」と戦略を語る。
Aβやタウの蓄積を早期に診断する技術としては、PET/MRIイメージング、脳脊髄液検査に加え、Aβ蓄積を推定できる血液バイオマーカーも開発されてきたため、「近い将来、血液検査などで脳内のAβ蓄積を診断し、抗Aβ薬で除去することができるようになるだろう」と予測する。
期待を集める抗体医薬であるが、薬価が高く、長時間かつ頻回の静脈投与が必要という欠点がある。先制医療として60歳代から使用するようになると、医療経済的な問題に加え、患者の社会生産性の問題も生じる。
そこで現在、富田教授らが目指しているのが「抗体医薬と同じように効く、安価な低分子の抗Aβ薬」である。脳内の免疫系を司るミクログリア細胞を活性化し、Aβを選択的に攻撃させるために、抗体以外の方法でAβに目印をつける――その研究で見いだされたのが、光酸素化という技術を用いた治療薬(光認知症療法)の可能性である。 富田教授と堀由起子准教授は、有機合成化学研究者の金井求教授(東大薬)、相馬洋平教授(現・和歌山県立医大)と共同研究を進め、2014年にin vitroの実験により、Aβの分子構造の一部に酸素を結合させると、Aβが凝集しにくくなることを明らかにしていた。Aβに酸素を結合させる方法として選んだのが、光酸素化という技術である。触媒となる化合物に光を当てると、光エネルギーを吸収して酸素ラジカルを発生させ、それが近くに存在するタンパクに結合する。その原理を応用して凝集Aβを酸素化し、さらなる凝集を防ぐ戦略だ。
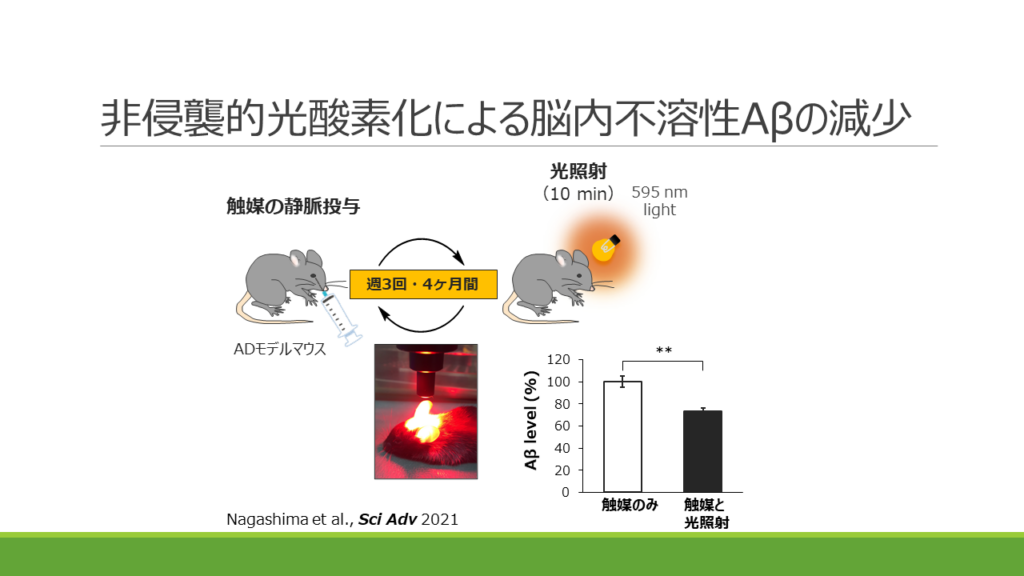
富田教授らは、ADモデルマウスの脳内にAβに選択的に結合する光触媒化合物を入れ、光を照射する実験を行った。すると、Aβの凝集が顕著に減少したばかりか、Aβの量も減少した。その後の研究で、酸素化されたAβはミクログリアにより迅速に分解されることがわかった。
治療法として確立するためにはいくつかの課題がある。治療薬本体は静脈投与で脳に移行しやすい低分子量光触媒化合物を開発済みだが、今後、経口化の研究も進める予定。また、光照射は、当初はマウスの頭部を切開して光ファイバを挿入して照射していたが、後に近赤外光を頭蓋骨の外から照射する方法を開発。昨年、非侵襲的光療法でマウスの脳内Aβが減少することを実証した。光照射装置はヒトでの実用化を目指して専門企業との共同研究を進めている。そう遠くない未来に、治療薬の内服と非侵襲的光照射だけで、ADの進行が止められる時代が来る――それが富田教授たちの夢だ。

また、富田教授は認知症研究の実験においては、「モデル動物の作成や管理に大変手間がかかる」と悩みを語る。ADを発症するまでに1年以上を要することも珍しくないが、論文に求められるn数は増えている。こうした背景から、「ケー・エー・シーが展開する動物実験受託サービスには非常に興味がある。ヒトミクログリア細胞などの供給や培養受託にもニーズがあるだろう」と期待を寄せる。
最後に富田教授は「認知症研究をネガティブに報道するニュースが出ることがあるが、20年近く研究してきて、着実に進歩していると断言できる。近い将来、必ず福音を届けられるだろう」と力強いメッセージを口にした。


