糖鎖が関わるがんの発症・悪性化の仕組み解明に期待
岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦准教授らの研究グループは31日、大阪大学や広島大学などとの共同研究で、がんの悪性化に関わる糖鎖合成酵素GnT-Vが、タンパク質を選んで糖鎖をつけることを発見したと発表した。 さらに、GnT-Vの一部であるNドメインと呼ばれる領域が、標的となるタンパク質を選ぶ上で不可欠であることも証明した。 これらの研究は、特定の糖鎖がどのようにして特定のタンパク質につくのか、という疑問の解明に向けて重要な知見を与えるとともに、糖鎖が関わるがんの悪性化の仕組みの解明にも役立つものと期待される。
同研究成果は、30日(日本時間)にThe Journal of Biological Chemistry誌のオンライン版で発表された。
糖鎖とは、ブドウ糖などの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、タンパク質や脂質などに結合した状態で存在している。
動物では、体内の半数以上のタンパク質に糖鎖がついている。タンパク質についている糖鎖には様々な形のものがあり、タンパク質ごとに形が異なり、同じタンパク質でも、健康なときと病気のときとでは糖鎖の形が変化することなどが知られている。
こうした疾患特異的な糖鎖の変化は、バイオマーカーとして実際に医療の現場でがんの診断などに使われている。
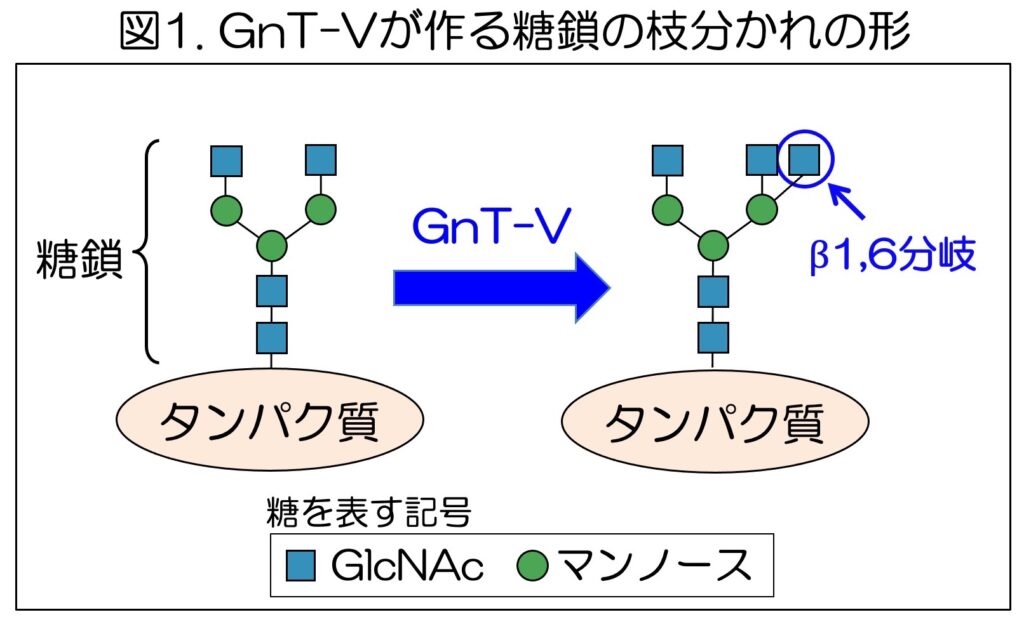
タンパク質につく糖鎖は、細胞の中で糖転移酵素(糖鎖合成酵素)と呼ばれる酵素の働きによって作られる。180種類ほど存在しているヒトの糖転移酵素の一つとして知られるGnT-Vは、細胞の中で、タンパク質についた糖鎖に作用し、糖鎖の枝分かれ構造を作る(図1)。
このGnT-Vが作るβ1,6分岐と呼ばれる枝分かれ構造は、がんの発症・進行と深い関係があることがわかっている。多くのがんで、GnT-VやGnT-Vが作る糖鎖の枝分かれ構造が増加し、GnT-Vの発現が高いがん患者では予後が悪くなる傾向を示すことなどから、GnT-Vはがんの治療標的の一つと考えられている。
また、GnT-Vは、糖鎖を持つ全てのタンパク質に一様に働くわけではなく、特定のタンパク質にだけ作用する。このように、個々の糖転移酵素が特定のタンパク質に作用するため、それぞれのタンパク質の上に固有の糖鎖が形作られる。
こうした複雑な糖鎖の合成の仕組みが、生体の機能維持や疾患の発症・悪性化に関わると考えられるが、タンパク質ごとに異なる糖鎖が作られる仕組みはほとんど判っていない。GnT-Vについても、どのように標的タンパク質を選んで作用しているのかは全くわかっていなかった。
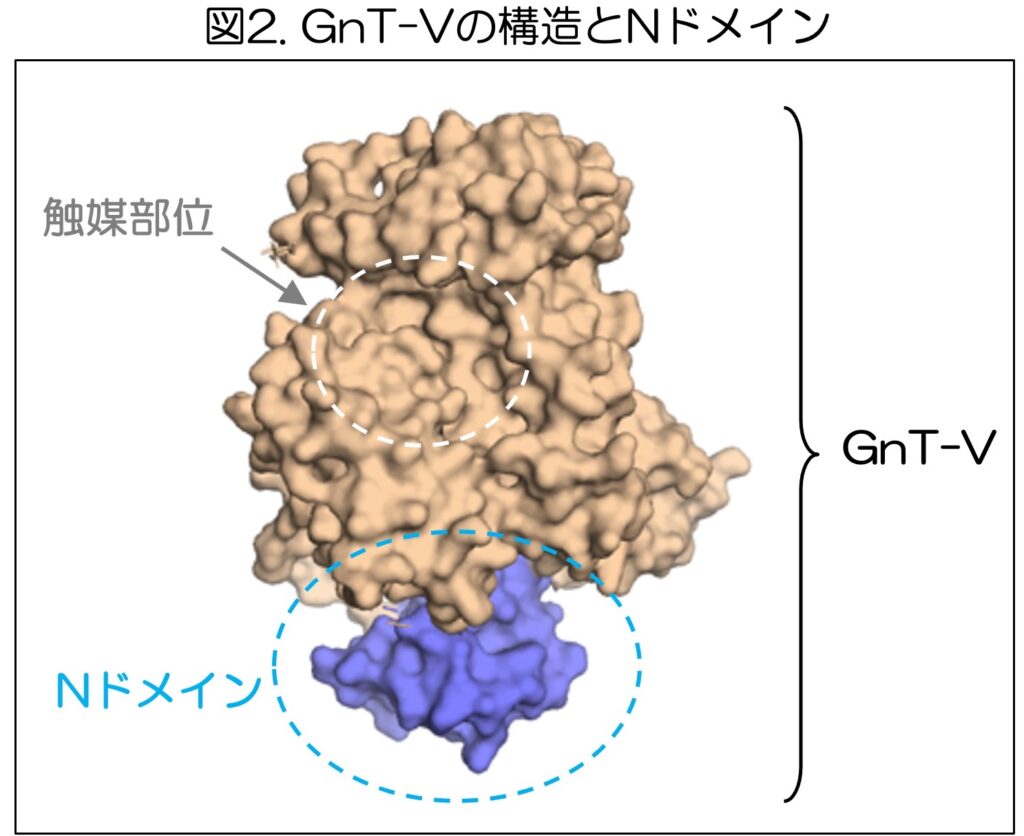
そこで、木塚氏らは、GnT-Vの中にあるNドメインと呼ばれる領域に注目して、この仕組みの解明に取り組んだ。
木塚氏らのこれまでの研究(https://www.gifu-u.ac.jp/about/publication/press/20180821.pdf)によって、GnT-Vの立体構造がわかっている(図2)。
GnT-Vには、糖鎖の枝分かれ構造を作る反応を触媒する部位の他に、働きが不明のNドメインと呼ばれる領域が存在している。木塚氏らの研究グループは、NドメインがGnT-Vの働きにおいて果たす役割を明らかにすることを目的として研究を行い、次の事例を明らかにしました。
まず、Nドメインの役割を明らかにするため、通常のGnT-Vと、Nドメインを持たないGnT-V(∆N)を細胞に導入し、細胞内でGnT-Vが作る糖鎖の枝分かれの量を調べた。細胞は、遺伝子組換えによってGnT-Vを欠損させたものを用いた。
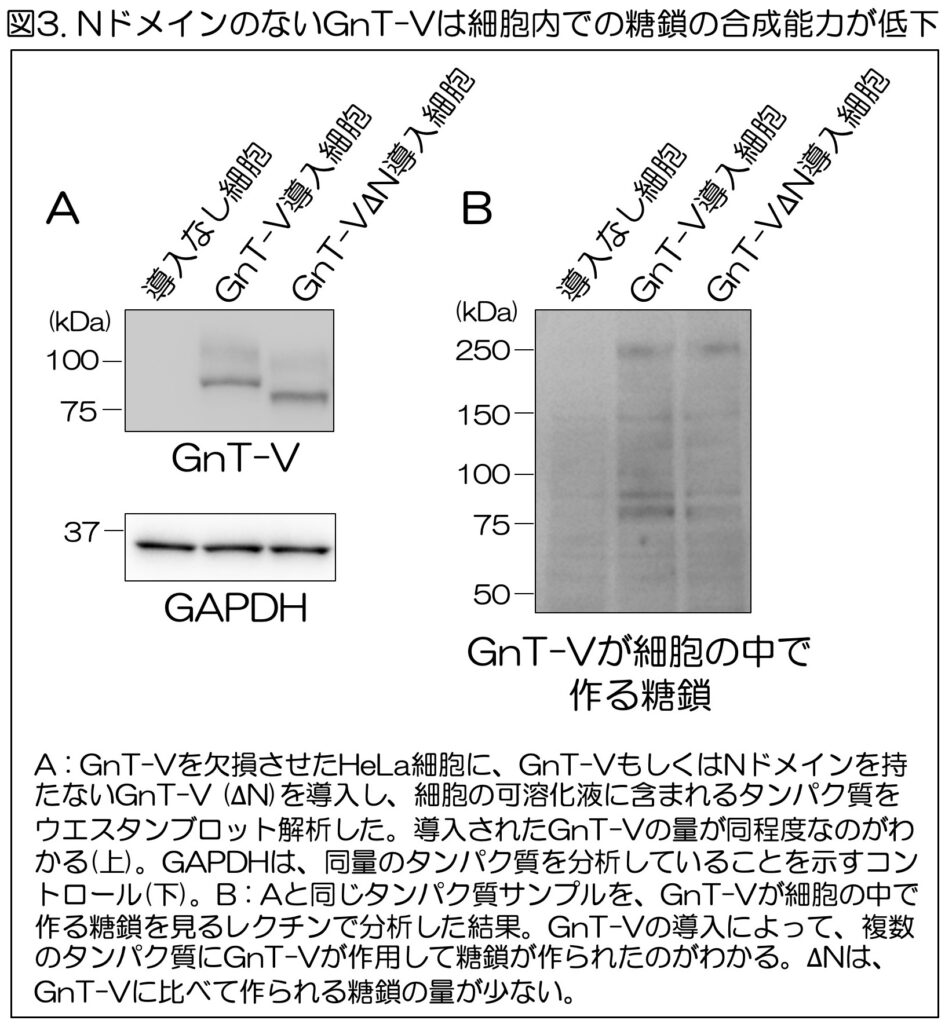
分析の結果、導入したGnT-Vと∆N自体は細胞中に同程度存在していたが(図3A)、GnT-Vによってタンパク質の上に作られる糖鎖の分岐量は、通常のGnT-Vと比べて∆Nの方が少ないことがわかった(図3B)。
このことから、GnT-Vが細胞内でタンパク質の上に十分な糖鎖の枝分かれ構造を作るためには、Nドメインが必要であることがわかった。
次に、NドメインがないとなぜGnT-Vが十分に働けないかを調べるため、木塚准教授らは、様々な基質を用いてGnT-Vがその基質上に糖鎖の枝分かれ構造を作る能力(酵素活性)を測った。基質として、糖鎖だけのもの2種類(図4、GnGnbi-PA、GnGnbi-Asn-PA)、糖鎖を持つ糖タンパク質3種類(α1AGP、transferrin、SOD3)、糖ペプチド1種類(SGP)を用いた。
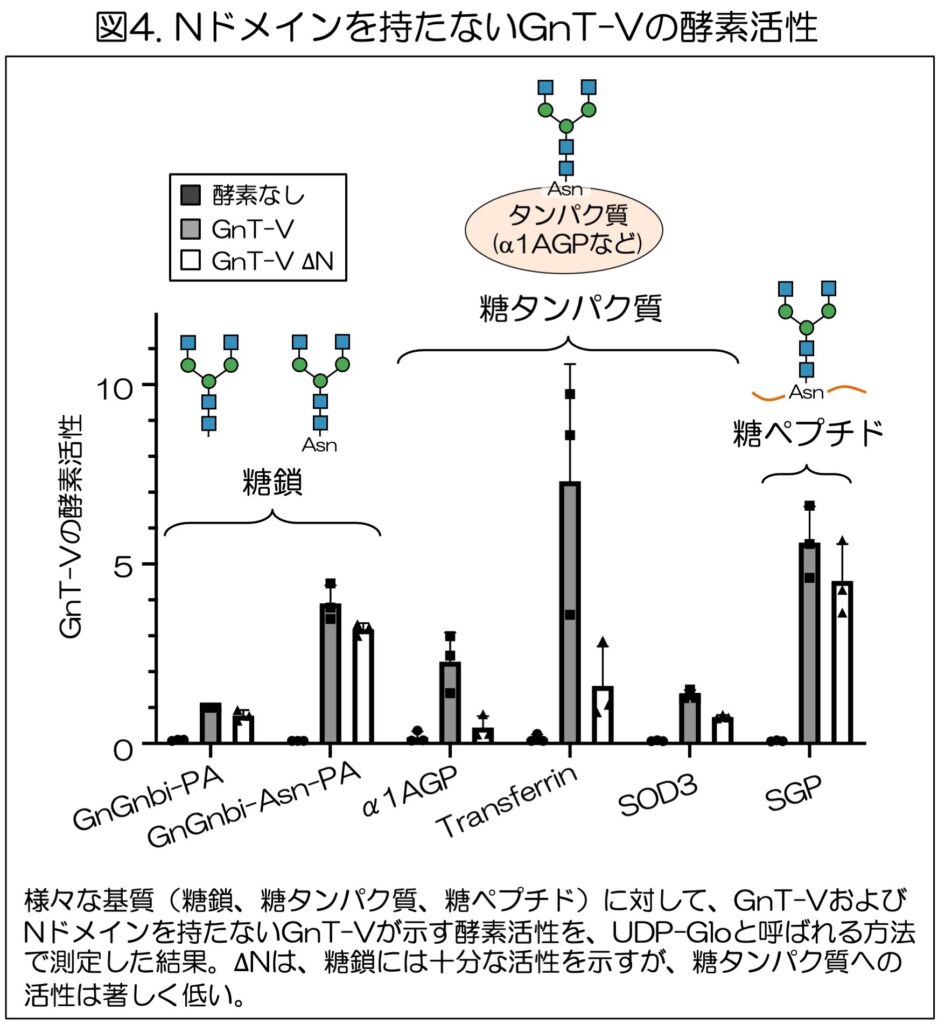
通常のGnT-Vは、程度は異なるが、全ての基質に対して糖鎖を合成する活性を示した。
一方∆Nは、糖鎖や糖ペプチドといった小さなものに対しては、通常のGnT-Vと同等の活性を持つ傍ら、糖タンパク質に対しては、3種類とも通常のGnT-Vに比べて活性が著しく低いことが判明した(図4)。
この結果から、Nドメインは、糖鎖の枝分かれ構造を作る活性そのものには無関係であるが、糖タンパク質という大きな基質の上の糖鎖への作用に不可欠であることがわかった。
細胞の中では、GnT-Vは遊離の糖鎖ではなく、糖タンパク質に対して本来作用するため、細胞の中で∆Nがタンパク質の上に作る糖鎖の量が少なかったのは、Nドメインがないことで、糖タンパク質に対する糖鎖合成の活性能が低下したためであると考えられた。
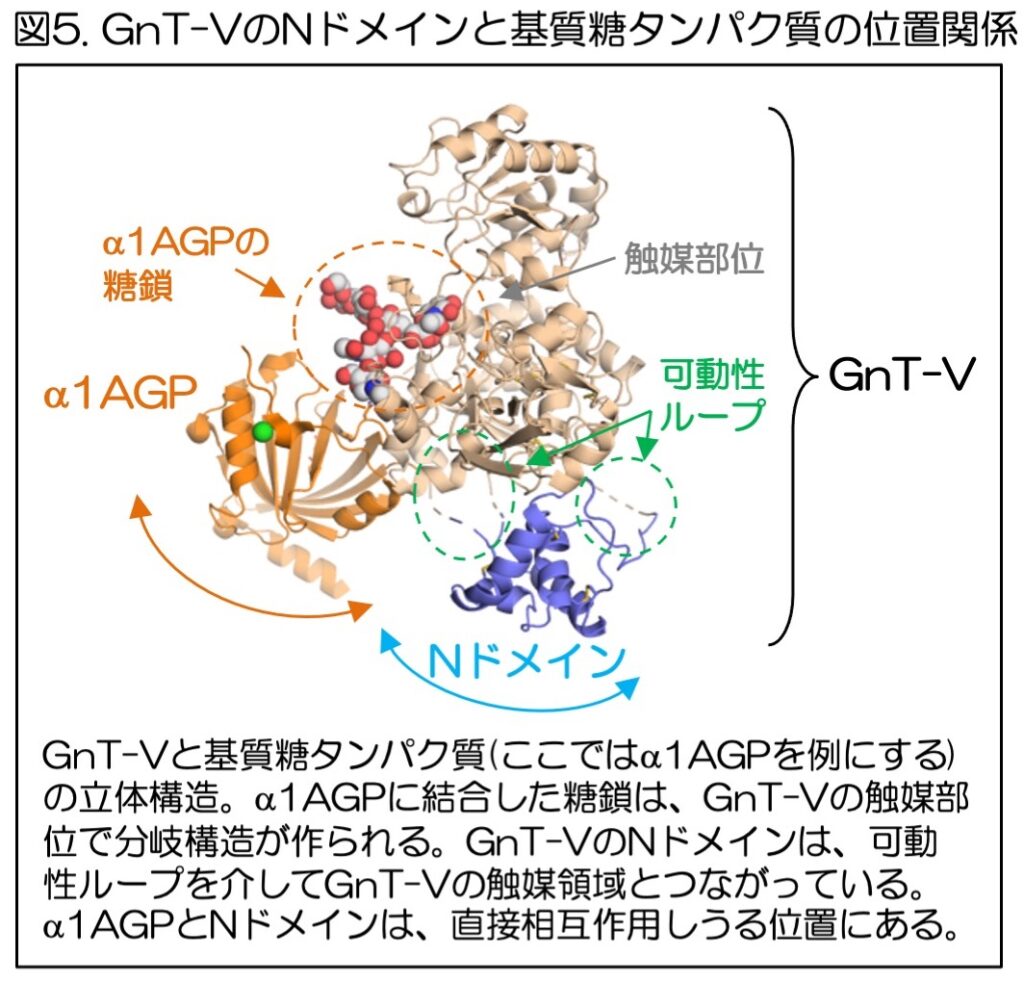
最後に、Nドメインが糖タンパク質に対する糖鎖合成の活性にどのように関わるかを明らかにするため、GnT-Vと糖タンパク質のドッキングモデルを作った(図5、この場合はα1AGPを例にしている)。
その結果、GnT-Vの作用を受ける糖タンパク質とNドメインはやや離れた位置に存在しているが、Nドメインは可動性のループによって触媒領域とつながっているため運動性が高く、また糖タンパク質もその空間的位置がゆらぐため、Nドメインは糖タンパク質と直接相互作用しうることがわかった。
これらの研究により、GnT-Vは、実際に糖鎖に枝分かれ構造を作る触媒領域の他に、Nドメインという直接的な触媒活性とは関係のない領域を使って、糖鎖合成を行う糖タンパク質かどうか選別していることが示された。
この知見は、GnT-VがNドメインによって基質糖タンパク質を直接認識し、それによって選ばれたタンパク質の糖鎖への作用を示唆している。
一方、Nドメインがどのようなタンパク質を選ぶのか、その詳細はまだ明らかになっていない。今後、Nドメインが認識するタンパク質がわかれば、GnT-Vがタンパク質を選んで糖鎖を作る仕組みがさらに解明されると期待される。
また、同研究は、糖鎖一般においてまだ未解明である、「なぜタンパク質ごとに異なる糖鎖がつくのか」、という疑問を考える上で重要な知見を与えるとともに、糖鎖が関わるがんの発症・悪性化の仕組みの解明に貢献すると期待される。


