先天性神経疾患やがんの病因解明・治療法開発に期待
新潟大学大学院医歯学総合研究科脳機能形態学分野の備前典久助教、竹林浩秀教授らの研究グループは、中枢神経系における新たな細胞生存メカニズム解明に成功した。
脳や脊髄などの中枢神経系の発生の際に神経前駆細胞とオリゴデンドロサイト前駆細胞の生存に必須の分子『Ddx20』を発見し、その分子作用メカニズムを明らかにしたもの。同研究成果は、先天性神経疾患や多発性硬化症などの脱髄疾患の病因解明・治療法開発への応用が期待される。
加えて、同研究により明らかになった分子作用メカニズムは、細胞生存のための基本的なしくみであると考えられ、がんを含む様々な組織の病態に関与する可能性がある。同研究は、新潟大学脳研究所モデル動物開発分野の﨑村建司名誉教授、阿部学准教授、京都府立医科大学の小野勝彦教授らとの共同研究で行われたもので、研究成果は、本年1月1日にセル・デス・アンド・ディファレンシエーション誌のオンライン版で先行公開された。
脳や脊髄を構成する中枢神経系は、神経前駆細胞の増殖と、神経細胞やグリア細胞への分化が適切に行われて構築される。転写因子Olig2は、一部の神経前駆細胞に発現し、運動神経やオリゴデンドロサイトの発生に必須の分子であるほか、神経前駆細胞の増殖にも寄与するなど多彩な機能を発揮する。だが、Olig2がこのような多様な発生プロセスをどのように制御しているかは未だ不明な点が多く残されている。
そこで同研究グループは、Olig2と結合する分子を探索し、その分子とOlig2が関わる発生メカニズムの解明を目指した。同研究では、まずOlig2と結合する分子の探索から始め、RNAヘリカーゼDdx20を同定した。
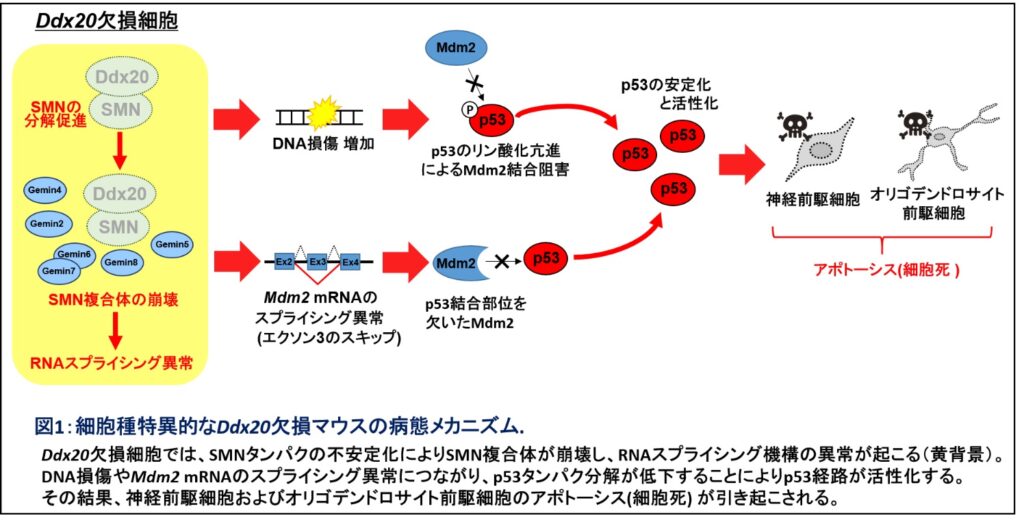
Ddx20は、RNAスプライシング、タンパク翻訳、転写などを制御する多機能な分子として知られている。発生期の中枢神経系でDdx20が欠損するマウスを作製し解析したところ、神経前駆細胞とオリゴデンドロサイト前駆細胞において、アポトーシス(apoptosis)と呼ばれる細胞死が急速に進むことがわかった。
細胞死の原因となるメカニズムを調べたところ、がん抑制遺伝子産物として知られるp53の過剰な蓄積が認められた。さらに、p53の蓄積は、ゲノムDNAが損傷し、p53を分解する因子をコードするMdm2遺伝子のRNAスプライシングに異常が生じて機能が喪失することが原因であると判明した。
Ddx20は、RNAスプライシングを制御するSMN複合体の構成因子としても知られている。興味深いことにDdx20欠損マウスでは、SMNタンパクが不安定化しており、RNAスプライシング機構に異常をきたしていた(図1)。
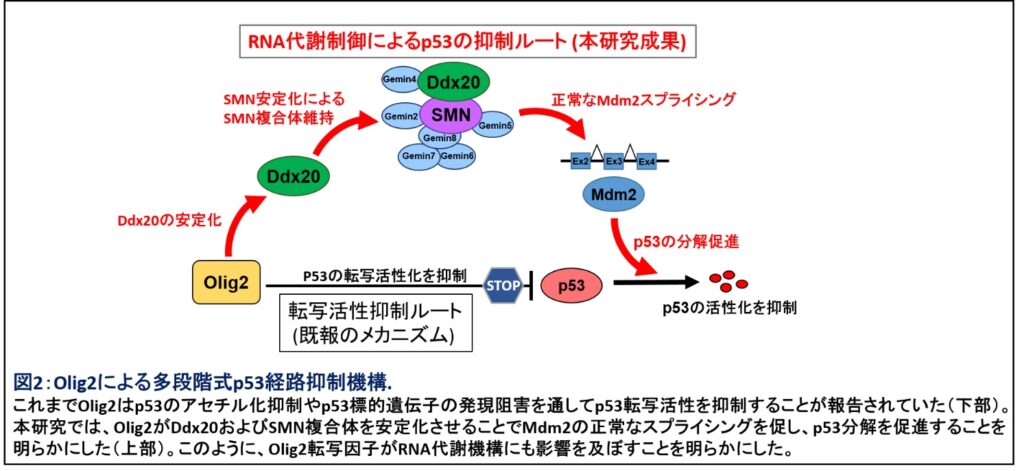
さらに、Olig2陽性細胞では、Olig2タンパクはDdx20を安定化させてDdx20の機能を維持し、p53の抑制を介して神経前駆細胞の増殖を促進することも明らかになった。
がん抑制遺伝子p53は、細胞の増殖、分化、細胞死などを調節して正常な個体発生に寄与している。同研究により、Ddx20によるRNA代謝制御系を介したp53経路の抑制が、中枢神経系の発生に必要不可欠であることがわかった。
これまでOlig2は、p53経路を抑制して神経前駆細胞の増殖を促進するメカニズムが知られていた。同研究でOlig2によるp53抑制機構の詳細なメカニズムの一端が明らかになった。加えて転写因子であるOlig2がDdx20を介してRNA代謝を制御する作用機序も明らかとなり、Olig2の転写調節にとどまらない多彩な機能が示された(図2)。
また、同研究グループは、これまでにDdx20がオリゴデンドロサイトの分化・成熟にも必須であることを明らかにしている(Simankova, Bizen他, Glia 2021:新潟大学プレスリリース 2021.7.21.)。これらの研究成果を総合すれば、Ddx20がオリゴデンドロサイトの発生の各ステップで必要不可欠な分子であることが証明された。
同研究により、Ddx20によるp53制御を介した中枢神経系発生メカニズムを明らかにしたが、Ddx20はRNAスプライシング以外にも、RNA輸送、翻訳、転写調節など多様な機能を有しており、同研究成果以外の仕組みによっても中枢神経系の様々な発生プロセスに関与している可能性が予想される。
また、Ddx20は、複数のがんの病態にも深く関与していると報告されている。Olig2は、グリオーマ(神経膠腫)やメラノーマ(悪性黒色腫)の進行にも関わっている報告もあり、Ddx20とOlig2の相互作用が、がんの発生や進行に関わっている可能性がある。
従って、今後のさらなる研究推進により、先天性神経疾患やがんの病因解明と治療法開発の糸口になることが期待される。