アルツハイマー治療の新規治療法開発への応用に期待
神戸医療産業都市推進機構(神戸市、理事長:本庶佑氏)は、アルツハイマー病の発症を促進すると考えられている脳血管障害の起きる分子メカニズム解明に初めて成功したことを明らかにした。
同研究成果は、先端医療研究センター神経変性疾患研究部の星美奈子研究部長、笹原智也研究員らの研究グループと、新潟大学脳研究所の柿田明美教授、他田真理准教授との共同研究によるもので、アミロスフェロイドとNAKα3の相互作用が、脳実質と血管の双方でアルツハイマー病の新たな創薬標的となり得ることを示唆する。


今後、同研究成果をもとに、脳と血管の二つの側面から相乗的にアルツハイマー病を治療できる全く新しい治療法の開発が期待される。なお、この研究成果は米国学術誌『iScience』に掲載される。
アミロイドβに由来する凝集体は、アルツハイマー病脳で起こる神経細胞死の原因と考えられているが、それに加えて、血管弛緩反応を阻害し脳血流を低下させるなどの血管障害の原因となることも示唆されていた。
とはいえ、様々な分子サイズのアミロイドβ凝集体がある中で、どれが、どういう分子メカニズムで血管障害を起こすかは、殆ど解明されていなかった。
同研究グループは、アルツハイマー病の神経細胞死の分子メカニズムの解明に長年取り組んでおり、まず、患者脳から神経細胞死の原因と考えられる約30分子のアミロイドβが集合し形成された球状構造体「アミロスフェロイド」を発見した(Hoshi et al., PNAS 100:6370, 2003: Noguchi et al., JBC 284:32895, 2009)。
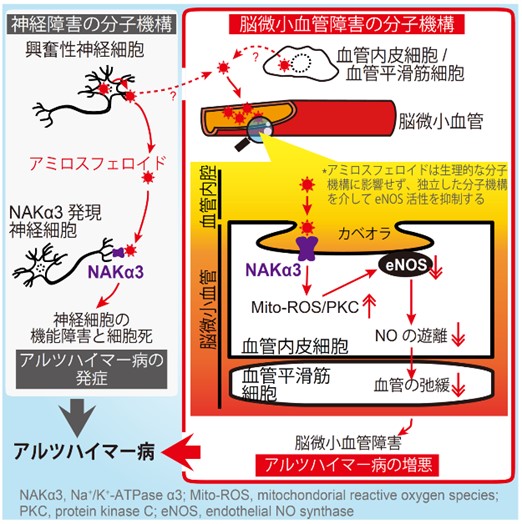
次に、アミロスフェロイドが神経細胞の生存と機能に必須であるα3型ナトリウムポンプ(NAKα3)に結合し、そのポンプ活性を阻害することで神経細胞死を誘導することを証明した(Ohnishi et al., PNAS 112:E4465, 2015)。
今回、笹原研究員らは、ラットの血管とヒト脳微小血管由来の初代培養細胞を駆使することで、驚いたことにアミロスフェロイドが、血管の内側を覆う内皮細胞上でNAKα3に結合し、生理的な制御機構とは異なる分子メカニズムで血管弛緩反応を阻害することを発見した。
加えて、興味深い発見として、神経と血管の双方でNAKα3がアミロスフェロイドの共通のターゲットとなるにも関わらず、下流での分子メカニズムは全く異なることも解った。
今回の研究成果のポイントは、次の通り。
・アルツハイマー病患者の脳微小血管において、不溶性アミロイドβ凝集体は血管内皮と血管平滑筋双方に 蓄積するが、水溶性であるアミロスフェロイドは主に血管内皮に沈着する
・アミロスフェロイドは、血管内皮の細胞膜上にある、シグナル伝達に関連する分子が集積するカベオラと呼ばれるくぼみに存在するNAKα3に結合することで、血管の弛緩反応を阻害する
・アミロスフェロイドとNAKα3が相互作用することで内皮型NO合成酵素がリン酸化され不活性化型になり、それによってNOが減少するために血管の弛緩が阻害されることを示した
・アミロスフェロイドによる内皮型NO合成酵素の不活性化は、ミトコンドリアにおける活性酸素種の産生とそれに続くプロテインキナーゼC活性化によって誘導される。これは従来報告されているNO産生の制御機構とは異なることが解った。


