吸入剤としての肺がん治療薬創出に期待
東京大学大学院工学系研究科マテリアル工学専攻・宮田完二郎准教授(ナノ医療イノベーションセンター客員研究員)は、10日に開催された第58回COINS セミナーで、「核酸医薬の実用化に資するナノマシン~送達困難な組織への核酸医薬デリバリー」をテーマに講演し、ナノミセル化技術により、気管支内投与されたアンチセンス核酸の肺組織滞留を大幅に改善することに成功したと発表した。同研究成果は、吸入剤としての肺がん治療薬の創出に繋がるものと期待される。
重篤な疾病は、特定の機能性タンパク質が過剰発現したり、また逆に発現しなかったりすることで発症しする。このタンパク質の発現を制御する核酸医薬には、アンチセンス核酸 (ASO)、低分子干渉 RNA (siRNA)、アプタマー、デコイなど様々なものがあり、抗体医薬に比べて安価に製造できる点が注目されている。だが、その一方で、生体内で不安定であることや、体外への排出速度が速いなど、生物学的利用率 (BA) が低いという欠点がある。
宮田氏らは、ナノ医薬技術が、核酸医薬の欠点を補い、用途に応じて設計されたナノミセルや、世界最小サイズとなるユニットポリイオンコンプレックス(uPIC)が、標的となる組織に選択的かつ効果的に薬剤を届ける上での有用性を、ヒト非小細胞肺がん細胞株であるA549-Lucを同所移植したマウスを用いて、ASO製剤(asTUG1)の局所滞留性をIVISで評価することで証明した。
呼吸器系疾患における吸入剤の貢献は大きく、気管支喘息や慢性呼吸器系疾患 (COPD) においては既に有効な吸入剤が上市されており、患者のQOLを大きく改善した。
宮田氏らは、がん細胞が持つ Taurine Upregulated Gene 1 (TUG1) という遺伝子に着目し、そのアンチセンス核酸(ASO)であるasTUG1 を、ヒト非小細胞肺がん細胞を同所移植したマウスに気管支内投与して、TUG1 の発現を抑制する研究を実施した。
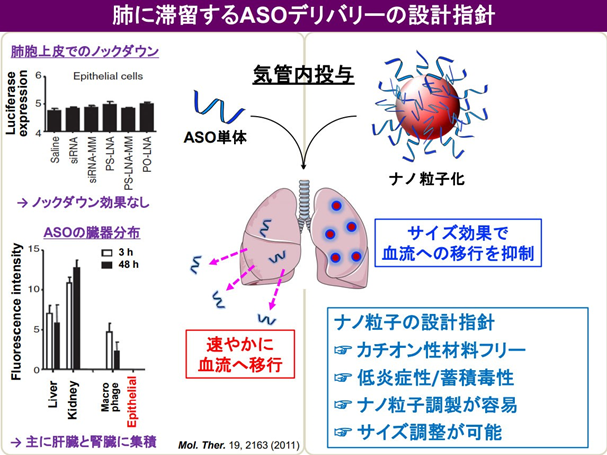
ASO は、投与後速やかに体外へ排出される性質があり、気管支投与においても肺には留まらずに肝臓や腎臓に速やかに移行して体外へ排出されてしまう(図1)。
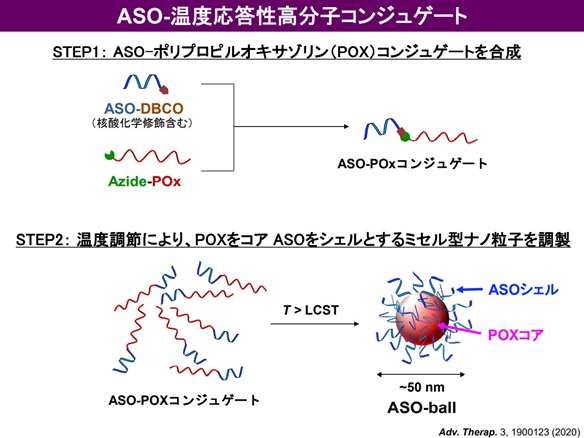
そこで、高分子ナノミセルに 蛍光標識 asTUG1を搭載して(図2)、ヒト非小細胞肺がん細胞(A549-Luc)から作成された同所移植モデルマウスに気管支内投与した。
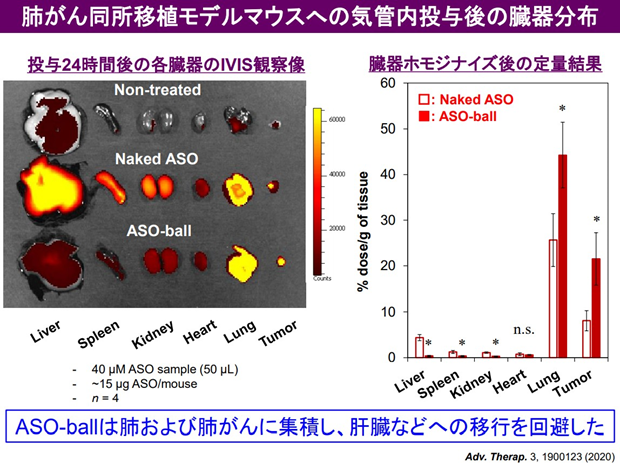
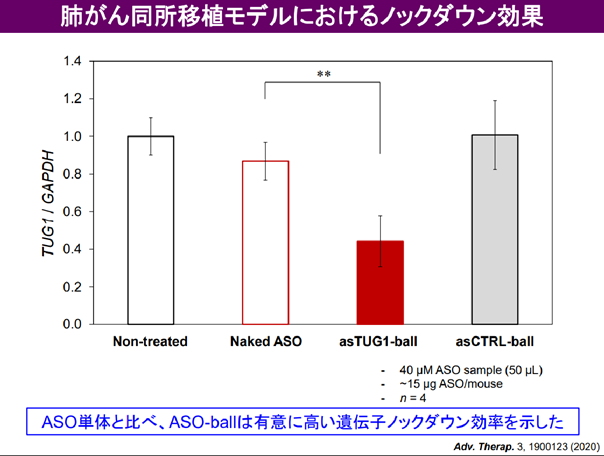
その結果、肺に長時間同ASO製剤を滞留させ(図3)、さらに、肺がん細胞内での標的遺伝子のノックダウンに成功した(図4)。
同研究は、将来的に、肺がん治療のための吸入剤創出に繋がることが期待される。


