
ナノ医療イノベーションセンター(iCONM、センター長:片岡一則氏)は18日にWebによる記者説明会を開催し、がんの発生原因のひとつであるc-Myc転写因子の細胞内産生量に応じて抗がん剤を放出する「c-Myc標的エピジェネティック治療薬JQ1のミセル化」に成功したと発表した。
同ミセルの開発は、東京大学大学院医学系研究科外科学専攻感覚・運動機能医学講座・耳鼻咽喉科頭頚部外科の松本有講師の研究グループおよび同学工学系研究科バイオエンジニアリング専攻のオラシオ・カブラル准教授の研究グループの共同研究によるもの。
c-Mycは、がん細胞の増殖や血管新生に関わるのみならず、細胞周期を変化させ正常な細胞分化を抑制するほか、がんの転移を促進することが知られている。
細胞増殖に関連する多くの遺伝子を調節する代表的ながん原遺伝子 (proto-oncogene) であり、バーキットリンパ腫における染色体転座など多くのがんの発生に関わっている。
さらに、c-MycはiPS細胞の初期誘導に必要な因子としても知られており、将来的にはiPS細胞由来のがん化抑制にも使える技術としての応用も期待される。

記者説明会で講演した喜納宏昭氏(ナノ医療イノベーションセンター・片岡喜納ラボ・副ラボ長/主幹研究員)によると、c-Mycを標的とした抗がん剤の開発は、幹細胞を直接攻撃できる利点があるため世界中で行われているがまだ成功した例はない。
その理由は、c-Mycを人工的に消失させたノックアウトマウスでは胎生致死(妊娠中の死亡)が起きることなどから「c-Mycは正常細胞にも必須の物質」であると考えられるからだ。従って、c-Myc阻害剤の開発には、がん組織への選択的送達が重要な鍵を握っていることになる。
そこで、既知の代表的な間接的c-Myc阻害剤であるJQ1を機能性ナノミセルに搭載させ、その有効性を調べた。JQ1は、BRD4 と呼ばれるc-Mycの発現を司るRNAポリメラーゼ IIの活性化に関与するブロモドメインタンパクに結合して、その作用を強力に阻害する。
その結果、RNAポリメラーゼの活性が弱まることでc-Mycの産生量が低下する。JQ1は、その強い遺伝子発現抑制作用からエピゲノム創薬の星として期待されたものの、投与後速やかに腎排泄されて消失するため生体内半減期が極めて短く、また、ほとんど水に溶けない。
従って、JQ1は、腎排泄を克服し、がんへの集積と持続的なデリバリーが必要で、「がんへ到達し、持続的に薬剤を放出するナノカプセルの開発が必須」であった。
ナノ医療イノベーションセンターでこれまでに開発してきた抗腫瘍高分子ナノミセルは、内含薬剤の①安定化、②排出抑制、③EPR 効果(がん組織への選択的薬物送達)、④腫瘍アシドーシスに基づく組織選択的薬剤放出の4作用が実証されている。
今回、腫瘍アシドーシスの環境に応じて、薬剤放出速度が迅速なもの (FR- JQ1)と、緩和なもの(SR-JQ1)の2種類のJQ1搭載ナノミセルをデザインした。
具体的には、JQ1を内含したナノミセルは、静脈内に投与されるとEPR効果により腫瘍組織内に漏出する。腫瘍組織は解糖系が亢進されているため乳酸が多く存在し、正常組織に比べて酸性となっている。
ポリエチレングリコールとポリアミノ酸からなる親水性ポリマーと疎水性のJQ1を 3-アミノプロピオンアルデヒド(脂肪族アルデヒド)のリンカーにより繋いだものとパラアミノメチルベンズアルデヒド(芳香族アルデヒド)をリンカーとして繋いだものの 2 種類の両親媒性ブロックポリマーを合成し、ナノミセルの基材とした(図1)。
SR-JQ1: 芳香族アルデヒドのリンカーを使用。酸性下で薬剤放出がマイルド
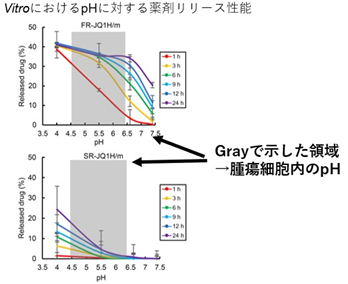
図1:ナノミセルのブロックポリマーに用いるリンカーの違いに基づく薬剤放出パターンの違い
それを水中で自己会合させミセル化させ担がんマ ウスに投与すると(図2)に示す抗腫瘍活性が得られた。
リンカーを脂肪族アルデヒドにした場合と、芳香族アルデヒドにした場合で、酸性度に応じた薬剤の放出パターンが大きく異なり、前者では速やかに、後者では穏やかに薬剤が放出される。そこで、前者のナノ医薬品をFR-JQ1、後者をSR-JQ1と命名した。

一方、柴崎仁志氏(東京大学大学院医学系研究科外科学専攻 耳鼻咽喉科・頭頸部外科学分野・腫瘍外来医師)は、FR-JQ、SR-JQ1の抗腫瘍効果とc-Mycの関連性などについて解説した。
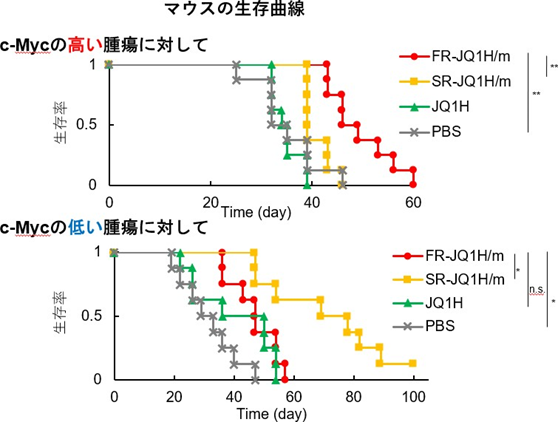
柴崎氏によると、これらのミセルを担癌マウスに静脈投与したところ、c-Mycの発現が高いがんを移植したマウスには内包薬剤を素早くリリースするミセル(FR-JQ1)が効果が高かった。
その一方で、c-Mycの発現が低いがんを移植したマウスには、ゆっくりリリースするミセル(SR-JQ1)の効果が高いことが示された。
また、マウス生体内での解析において、素早くリリースするミセルは、早期の腫瘍内における内包薬剤の急激な放出を、ゆっくりリリースするミセルは、長期にわたりミセルが癌に集積し、腫瘍内での持続的な放出(徐放)が確認された。
これらの実験結果から、c-Myc発現量を解析してそれに応じたミセルを選択し、がんへの薬剤放出レベルを変えることで、抗がん剤の効果をさらに高めたprecision nanomedicine (個別化ナノ医療)への可能性が示された。特に、同手法により、膵がん、白血病、非小細胞肺がんなどへの高い効果が期待される。
同ミセルの技術は、すでに米国で特許 (PCT/JP2017/30150:(US)16/326,837 (10441662)成立)が成立しており、大手製薬会社とFeasibility studyを進めている。


