東京医科大学分子病理学分野の黒田雅彦主任教授らは19日、アセロラを含む植物果汁から抽出したエクソソーム様小胞を用いた新たなドラッグデリバリーシステム(Drug Delivery System; DDS)を開発したと発表した。開発されたDDSは、核酸医薬への応用によりその経口投与が可能となるため、核酸医薬品の適応性拡大が期待される。今後、この成果をもとに、AMED橋渡し研究拠点事業の支援を受けて、経口投与核酸医薬品の開発が行わる。
同研究は、日本学術振興会科学研究費補助金並びに文科省私立大学戦略的研究基盤形成支援事業の支援のもとで行われたもの。研究成果は、国際科学誌 Molecular Therapy – Methods & Clinical Development(オンライン版)に10日付けで掲載された。
核酸医薬は従来の低分子化合物や抗体医薬とは異なり、遺伝子発現の制御を標的にできることで注目を集めている。特に、昨年からのコロナ禍における新型コロナワクチン開発競争では、新規の創薬モダリティとしてmRNAワクチンを含む核酸医薬が世間に印象づけられた。
その一方で、生体内での安定性や標的臓器への輸送などドラッグデリバリーの面でまだ課題が多く残っているものの、これらの解決を目的として分解酵素からの保護や標的臓器への特異性を上げるため化学修飾技術や、リポソーム製剤などのナノキャリアの開発が進んでいる。
近年、エクソソームを含む細胞外小胞(Extracellular Vesicles; EVs)の機能や特徴が明らかとなり、その性質を利用したDDSが注目されている。生体内において天然に存在するシステムであるのに加え、EVsに目的の核酸医薬を内包させることで生体内の分解酵素からの保護や、小胞膜に存在する分子の特異性を利用したDDSなど様々な応用方法が考えられる。
エクソソームに対する世の中の関心が高まる以前から、黒田氏らはエクソソームを核酸医薬DDSのキャリアーとして用いるための開発を進め、上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)に高い親和性を有するGE11ペプチドを膜状に発現した改変エクソソームを作製。
腫瘍抑制性のmiRNA(let-7)を内包して乳がんモデルマウスに投与し、この改変エクソソームが腫瘍抑制効果を有することを明らかにした(Ohno SI et. al. Mol Ther. 2013)。
このようにエクソソームを用いたDDSによる核酸治療の可能性を示した一方で、臨床応用を目指すとエクソソームの供給には大量の培地を用いた細胞培養とその培養上清からのエクソソーム分画の収率に問題があることも浮き彫りになってた。
また、単離されEVsは、細胞膜成分から構成されているがゆえに、凍結融解により分解されやすいことも明らかとなっており、医薬品としての供給・保存の面で懸念が残っていた。
そこで、低コストで安定的に多量生産可能なエクソソームの探索を目的とし、植物にもエクソソーム様小胞が存在し、動物細胞由来小胞と同様に細胞間相互作用に関与しているため、黒田氏らはDDSのキャリアーの候補として植物由来小胞に着目した。
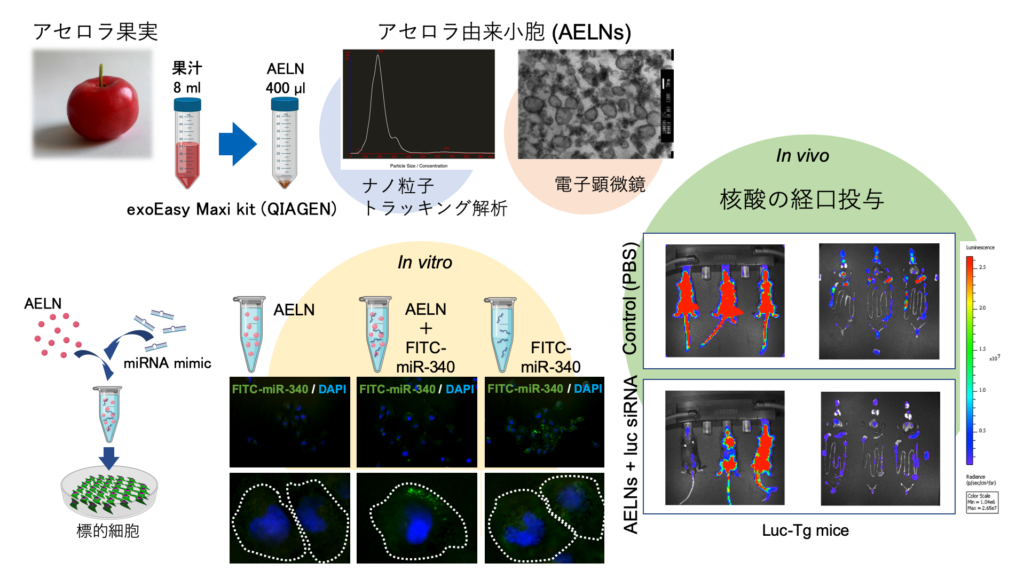
数種類の果物を用いて試行錯誤した結果、キントラノオ科植物のアセロラ果実が安定供給可能であり、その果汁からエクソソーム様小胞も高い効率で回収可能であることを見出した。
さらに、凍結保存したアセロラ果実、果汁からも形態的には遜色のない小胞分画が抽出可能であり、同研究においてアセロラ果汁由来小胞を担体として新規ドラッグデリバリーシステム、特に経口投与による標的臓器への核酸医薬の送達について開発を行った。
同研究では、アセロラ果汁から抽出されたエクソソーム様小胞におけるDDSキャリアーとしての有用性を示すために、①アセロラ由来小胞と核酸医薬の複合体の形成法、②in vitro培養系を用いたアセロラ由来小胞―核酸医薬複合体の細胞への取り込み、③in vivoモデルマウスを用いたアセロラ由来小胞―核酸医薬複合体の経口投与における効果について検討し、次の3つの結果が得られた。
①アセロラ由来小胞(Acerola Exosome-Like Nanovesicles: AELNs)と核酸医薬の複合体の形成法の確立
動物細胞由来のエクソソームに任意の核酸を内包させる技術としては、エレクトロポレーション法やリポフェクション法などが試みられてきましたが、効率よくエクソソームを改変する手法はいまだに確立されていないのが現状である。
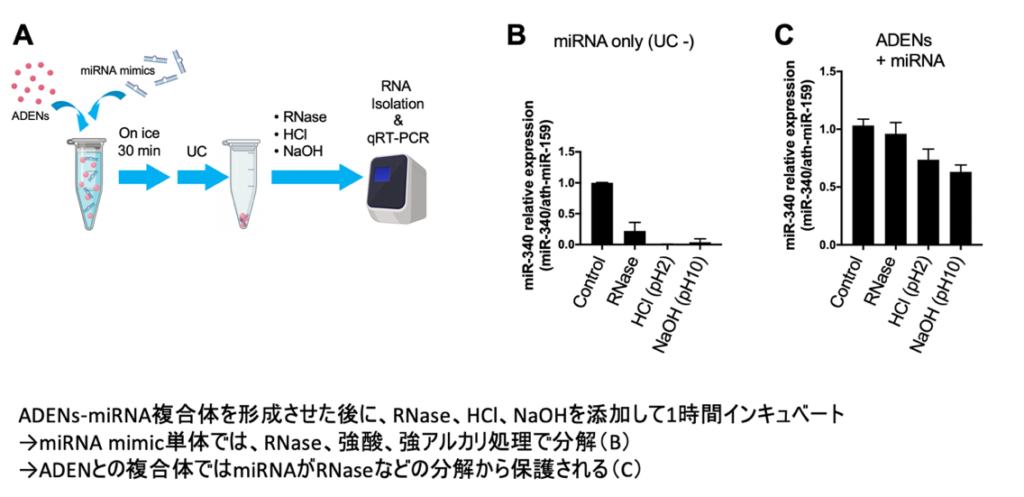
黒田氏らの研究チームもエレクトロポレーションを含む数種類の方法でアセロラ由来小胞内に核酸の導入を試みたが、結果的にAELNs(2.2×10^9 particles)と合成miRNA(hsa-miR-340)を一定濃度で混合して氷上で30分静置するだけで複合体を形成させることができた。
さらに、AELNsと複合体を形成した核酸(合成miRNA)は下図に示す様にRNase、強酸(pH2)、強アルカリ(pH10)に耐性を示した。
②in vitro培養系を用いたAELNs―核酸医薬複合体の細胞への取り込み
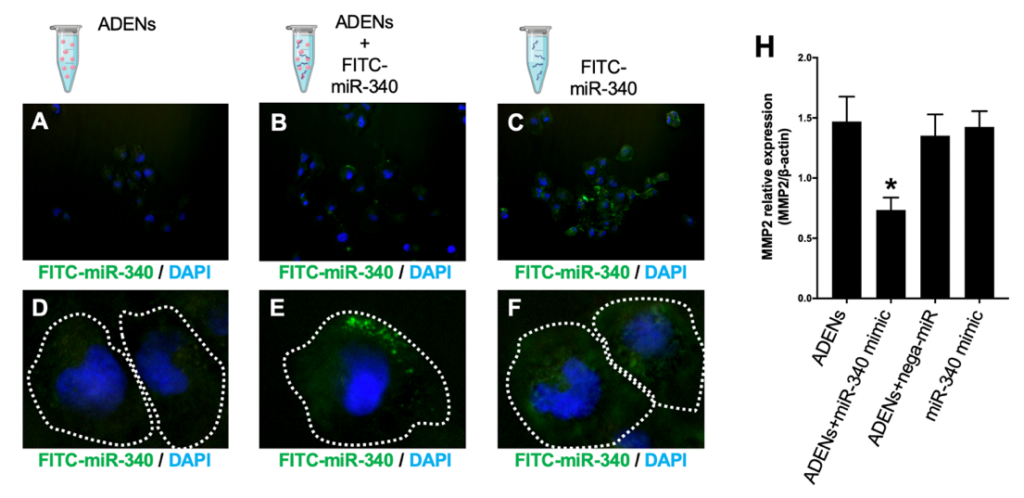
次に、氷上30分のインキュベートで形成させたAELNsと蛍光標識した合成miR-340の複合体を培養細胞に添加して、細胞内への取り込みを視覚的に確認した。図Eに示す様に取り込まれたmiRNAのシグナル(緑色)が細胞質内で観察されました。
また、取り込まれた合成miR-340が、細胞内で本来の機能を示しているか確認するためにmiR-340の標的遺伝子であるMMP2の発現をRT-PCRで確認した結果、下図Hに示す様にAELN―miR-340複合体を添加した細胞でMMP2の発現が低下しているのを明らかにした。
③in vivoモデルマウスを用いたAELN―核酸医薬複合体の経口投与における効果
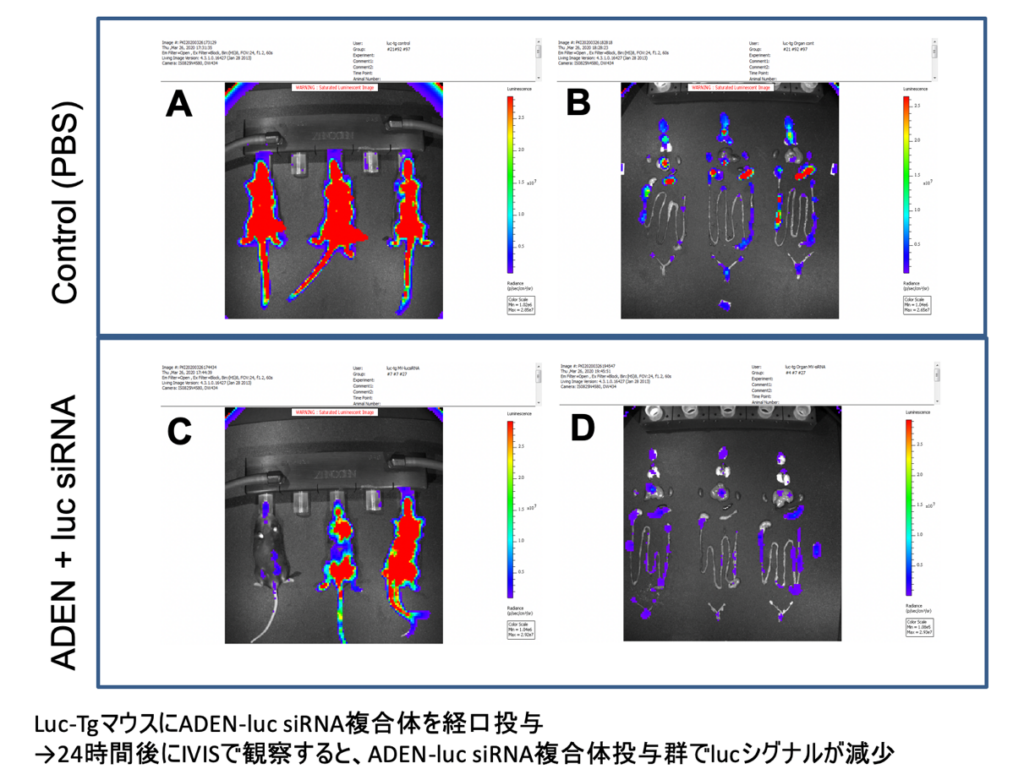
核酸の経口投与モデルとして、AELNsと核酸の複合体をマウスに経口投与して各組織への到達と薬理効果を検討した。下図C、Dに示すようにルシフェラーゼを発現しているトランスジェニック(Tg)マウスを用いて、AELN―ルシフェラーゼsiRNA複合体を経口投与すると24時間後に全身のルシフェラーゼ活性が抑制されていた。
2018年に世界初のRNAi(siRNA)医薬patisiranが誕生し、脂質ナノ粒子に封入された送達キャリアーを搭載したはじめての核酸医薬としても注目された。
また、2016〜2018年は、CpGオリゴを含む5つの核酸医薬が立て続けに上市されており、核酸医薬がコンスタントに実用化されるフェーズに到達したことが伺える。
如何に副作用なく効率的に標的へと届けることが可能な技術が必須であり、今回、同研究で示したアセロラ小胞という天然物を担体として用いた核酸の経口投与法は、核酸医薬DDSにおけるブレイクスルーとなり得ると考えられ、創薬期間が短く低コストであるメリットを活かした核酸医薬品の基盤への応用が期待できる。