インサイト・ジャパンは22日、がん治療薬「ミンジュビ」について、リツキシマブおよびレナリドミド併用による再発または難治性の濾胞性リンパ腫(FL)を効能・効果として、製造販売承認を取得したと発表した。これは日本におけるミンジュビの初めての製造販売承認である。
同承認は、日本在住の患者を含む成人患者654名が参加した国際共同P3試験(inMIND 試験)に基づくもの。同試験では、ミンジュビをリツキシマブおよびレナリドミドと併用した群において、対照群と比較して無増悪生存期間(PFS)が統計学的に有意に改善した。
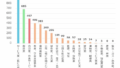
ミンジュビ併用群のPFS 中央値は22.4ヶ月であり、対照群の13.9ヶ月に対し、有意な延長が認められた。ハザード比は0.43、p 値は0.0001 未満で、進行リスクの低減が示された。
この結果は独立判定委員会でも確認され、プラセボ群では無増悪生存期間(PFS)の中央値が16.0 ヶ月のところ、ミンジュビ群では未到達であった。ミンジュビは概ね良好な忍容性を示し、呼吸器感染症、下痢、疲労が最も一般的な有害事象であった。
FLは日本で2番目に多いB細胞性非ホジキンリンパ腫(NHL)の緩徐進行型であり、全NHLの13.5%を占めている 。根治が困難とされ、約20%の患者が治療開始後2年以内に進行または再発を経験する。
この早期進行(POD24)は予後が著しく不良であり、5 年生存率はわずか34~50%である。治療法の進歩にもかかわらず、再発または難治性のFL に対する追加治療選択肢のアンメットニーズは依然として大きい状況だ。
◆石田靖之インサイト・ジャパンジェネラルマネージャーのコメント
ミンジュビとリツキシマブおよびレナリドミドの併用療法は、本邦において再発または難治性の濾胞性リンパ腫に対して、初めて且つ唯一のCD19 及びCD20 の両方を標的とした免疫療法で、本日の承認により同疾患に対する治療は大きな節目を迎えた。
ミンジュビは、無増悪生存期間を延長することで、化学療法以外の新たな治療選択肢を提供する。本承認は、日本においてこの難治性疾患に向き合う患者さんとその家族のアンメットメディカルニーズ解消に向けた、当社のコミットメントを示すものである。